Download Laporan Praktikum Pembuatan Ester dan landasan teori mengenai Pembuatan Ester lengkap dengan pembahasan dalam format PDF. Laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
BAB I PENDAHULUAN
Tujuan :
Dapat Melakukan sintesis ester (esterifikasi)
Latar Belakang
Dikehidupan sehari-hari, kita sering kali mengkonsumsi makanan serta minuman yang beraroma seperti buah-buahan yang tidak terbuat dari buah asli. Aroma tersebut terbuat dari senyawa ester, yang memiliki aroma bermacam-macam tergantung ester penyusunnya. Kebanyakan ester adalah zat yang berbau enak serta menyebabakan cita rasa dan harum dari banyak bunga dan buah-buahan.
Ester dapat dibuat oleh suatu reaksi keseimbangan antara suatu alkohol dan suatu asam karbon. Ester dinamai menurut kelompok alkil dari alkohol dan kemudian alkanoat (bagian dari asam karbon).
BAB II KAJIAN PUSTAKA
Ester
Senyawa ester merupakan senyawa turunan dari asam karboksilat sehingga bisa dikatakan sama tetapi ada perbedaan yaitu pada unsur hidrogen asam diganti oleh gugus alkil. Dalam pemberian nama senyawa ester pertama disebutkan terlebih dahulu gugus alkil esternya kemudian diikuti nama asam karboksilatnya dengan menghilangkan nama asam (Wardiyah, 2016).
Menurut Keenan 1980, ester diturunkan dari asam karboksilat dengan mengganti gugus OH dengan gugus OR (R adalah gugus alkil atau aril). Ester merupakan senyawa organik yang bersifat netral, tidak bereaksi dengan logam Na dan PCl3. Rumus umum ester adalah RCOOR’ dimana R dan R’ adalah gugus organik. Ester yang terdiri dari asam-asam yang berat molekul rendah dan alkohol merupakan senyawa-senyawa cair yang tidak berwarna, sedikit larut dalam air dengan bau semerbak, dan mudah menguap. Ester dari beberapa asam karboksilat dengan rantai panjang terdapat secara alamiah didalam lemak, lilin, dan minyak .
Struktur kimia ester
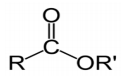
(Sihabudin, 2017)
Tata Nama Ester
Ester mempunyai nama IUPAC alkil alkanoat. Tata nama ester hampir sama dengan asam karboksilat tetapi pemberian nama pada ester diawali dengan menyebut nama gugus alkil atau aril yang menggantikan atom H dalam gugu -COOH pada asam-asam karboksilat induknya kemudian diikuti nama asam tersebut tanpa menyebut kata asam. Gugus karbon yang terikat pada atom O (gugus R’) diberi nama alkil dan gugus R-COOH diberi nama alkanoat.
Dari asam format (HCOOC) :
HCOO-CH3 metil formar
HCOO-CH2-CH3 etil format
HCOO-CH2-CH2-CH3 n-propil format
Dari asam asetat (CH3COOH) :
CH3COO-CH3 metil asetat
CH3COO-CH2-CH3 etil asetat
CH3COO-CH2-CH2-CH3 n-propil asetat
Sifat-Sifat Ester
Sifat Fisis Ester
- Ester suku rendah merupakan zat cair yang mudah menguap dengan bau harum dari beberapa buah-buahan dan bunga-bungaan.
- Ester suku tinggi merupakan minyak, lemak, atau lilin.
- Semakin banyak jumlah atom C semakin tinggi titik didihnya
- Senyawa ester pada umumnya sedikit larut dalam air
- Ester lebih mudah menguap dibandingkan dengan asam atau alkohol pembentuknya.
Sifat Kimia Ester
Ester dapat bereaksi dengan basa membentuk garam dan alkohol
R-COOR’ + KOH –> R-COOK + R-OH
Reaksi Esterifikasi
Reaksi esterifikasi asam karboksilat adalah reaksi pembentukan ester dengan berbahan dasar asam karboksilat. Ester asam karboksilat ini
merupakan suatu senyawa yang mengandung gugus -COOR dengan R yang
berbentuk alkil maupun aril. Untuk memperoleh rendemen tinggi dari
ester tersebut, kesetimbangan harus digeser ke arah sisi ester dengan
menambahkan salah satu pereaksi secara berlebih. Kuat asam dari asam
karboksilat hanya memainkan peranan kecil dalam laju pembentukan ester.
Esterifikasi adalah suatu reaksi ionik yang merupakan gabungan dari reaksi adis dan reaksi penataan ulang eliminasi. Esterifikasi juga dapat
didefinisikan sebagai reaksii antara asam karboksilat dan alkohol.
Esterifikasi dapat dilakukan dengan menggunakan katalis enzim (lipase) dan asam anorganil (asam sulfat dan asam klorida), dengan berbagai
variasi alkohol biasanya metanol, etanol, 1-propanol, amyl alkohol dan
lain – lain. Asam anorganik yang digunakan sebagai katalis akan
menyebabkan asam karboksilat mengalami konjugasi sehingga asam konjugat dari asam karboksilat tersebutlah yang akan berperan sebagai
substrat.
Menurut Anshory 2003, Seperti kebanyakan reaksi aldehida dan keton, esterifikasi suatu asam karboksilat berlangsung melalui serangkaian tahap protonasi dan detonasi. Oksigen karbonil diprotonasi, alkohol nukleofilik menyerang karbon positif dan eliminasi air akan menghasilkan ester. Reaksi esterifikasi :
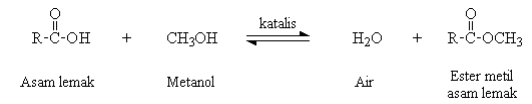
Katalis yang digunakan dalam esterifikasi dapat berupa katalis asam atau
katalis basa dan berlangsung secara reversibel. Untuk memperoleh rendemen tinggi dari ester tersebut, kesetimbangan harus digeser ke arah
sisi ester dengan menambahkan salah satu pereaksi secara berlebih. Kuat asam dari karboksilat hanya memainkan peranan kecil dalam laju pembentukan ester.
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum pembuatan ester ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum pembuatan ester ini, sebagai berikut:
Alat
- gelas kimia
- gelas ukur
- labu alas bulat
- corong pisah
- spatula
- pipet tetes
- batang pengaduk
- erlenmeyer
- corong pisah
- kondensor
- statif dan klem
- neraca
- seperangkat alat refluks
Bahan
- asam asetat glasial
- aquades
- n-butil alkohol
- NaHCO3
- MgSO4
- H2SO4 pekat
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum pembuatan ester :
- Masukkan 45ml n-butil alkohol dan 60ml asam asetat glasial ke dalam labu alas bulat
- Tambahkan 1ml H2SO4 pekat dan masukkan batu didih
- Kemudian lakukan refluks selama 3 jam
- Tuangkan campuran dalam 250ml aquades dalam corong pisah, lalu pisahkan campuran ester dan air
- Cuci lapisan ester dengan 100ml air serta dengan 25ml NaHCO3 jenuh
- Keringkan dengan MgSO4 anhidrat, kemudian saring
- Masukkan filtrat ke dalam labu destilasi
- Tambahkan batu didih dan lakukan destilasi
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
| No. | Perlakuan | Hasil |
| 1. | Mengukur 45ml n-butil alkohol dan 60ml asam asetat glasial dengan gelas ukur, kemudian memasukan kedua larutan tersebut ke dalam labu alas bulat | 45ml n butil alkohol dan 60ml asam asetat glasial terukur dengan baik, dan berada pada labu alas bulat |
| 2. | Menambahkan 1ml asam sulfat pekat | terbentuk dua lapisan, dengan lapisan atas bening dan lapisan bawah berwarna putih |
| 3. | Campuran direfluks selama 3 jam | Larutan mendidih dan bercampur membentuk campuran heterogen |
| 4. | Menuangkan campuran dalam 250ml air ke dalam corong pisah dan mengambil lapisan ester | Terebentuk dua lapisan, lapisan bawah bening (air) dan lapisan atas putih (ester) |
| 5. | Mencuci lapisan ester dengan 100ml aquades dan mengambil lapisan ester | Terebentuk dua lapisan, lapisan bawah bening (air) dan lapisan atas putih (ester) |
| 6. | Mencuci kembali dengan 25ml NaHCO3 dan mengambil lapisan ester | Terebentuk dua lapisan, lapisan bawah bening (air) dan lapisan atas putih (ester) |
| 7. | Menambahkan 6mg MgSO4 anhidrat ke dalam lapisan ester kemudian menyaringnya | MgSO4 tidak larut dalam ester, ester menjadi bening ketika disaring, dan terbentuk gumpalan |
| 8. | Mendestilasi ester | Didapatkan ester dengan titik didih 125C-130C dengan volume 9ml |
B. Pembahasan
Adapun pembahasan dalam laporan praktikum pembuatan ester ini adalah sebagai berikut :
Pada Praktikum kali ini kami melakukan percobaan pembuatan ester atau yang bisa disebut sebagai reaksi esterifikasi. Proses esterifikasi adalah reaksi reversibel antara suatu asam karboksilat dengan suatu alkohol. Praktikum ini dilakukan dengan tujuan agar mahasiswa mengetahui cara dan mampu untuk mensistesis ester. Pada langkah awal kami mereaksikan 45ml n-butil alkohol dengan 60ml asam asetat glasial untuk menghasilkan n-butil asetat. n-butil asetat merupakan ester yang berbau pisang dan berwarna bening kekuningan. n-butil alkohol pada percobaan ini bertindak sebagai senyawa pembatas yang akan habis bereaksi sedangkan asam asetat glasial akan bersisa. Reaksi yang terjadi :
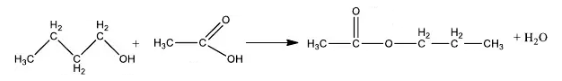
Terjadi mekanisme reaksi pada pencampuran n-butil alkohol/ butanol dan asam asetat glasial yaitu gugus OH dari butanol mengikat 1 H asam asetat glasial membentuk H2O, sedangkan gugus asam asetat glasial yang telah kehilangan 1 H dan butanol yang telah kehilangan gugus OH-nya membentuk butil asetat sehingga bisa dikatakan bahwa gugus butil pada alkohol mengganti gugus OH pada asam asetat glasial. Hal ini disebut reaksi penggantian/substitusi. Reaksi esterifikasi merupaka reaksi revelsibel yang sangat lambat, maka pada reaksi ini kami menambahkan 1ml H2SO4 yang berfungsi sebagai katalis. Hal ini agar dapat menurunkan energi aktivasi sehingga kesetimbangan reaksi lebih cepat terjadi. Reaksi ini termasuk reaksi endoterm, karena campuran tersebut menyerap panas dari lingkungan. Suasana harus dibuat panas agar reaksi esterifikasi terus berlanjut sampai mencapai kesetimbangan.
Pada reaksi esterifikasi ini terbagi menjadi 2 tahapan, tahap pertama adalah refluks. Pada proses refluks terjadi pereaksian antara n-butil alkohol dengan asam asetat glasial dalam reaktor, yang bertujuan untuk mempercepat reaksi. Proses ini dilakukan selama 3 jam. Refluks merupakan metode pemanasan yang tidak mengurangi massa dan energi dari sistem reaktor. Hal ini terjadi karena uap hasil pemanasan mengalami pendinginan di kondensor sehingga terkondensasi kembali menjadi cairan dan masuk kembali ke reaktor, sehingga lebih effisien. Proses ini dapat dihentikan ketika suhu cairan dalam reaktor mencapai suhu maksimal dan telah konstan. Hasil yang didapatkn dari proses refluks adalah campuran heterogen yang terdapat 2 lapisan, lapisan atas berwarna putih sedangkan lapisan bawahnya bening. Campuran ini berbau wangi ester, terdapat air dan sisa dari asam asetat glasial yang berwarna bening kekuningan. Akibatnya suhu masih jauh dari titik didih murni n-butil asetat, sehingga perlu dilakukan tahap kedua yakni ekstraksi.
Pada proses pemurnian ester dilakukan dengan cara ekstraksi dengan menggunakan corong pisah sebagai ekstraktor. Kami menambahkan 250ml aquades dalam corong pisah yang berisi n-butil asetat yang belum murni, untuk memisahkan air yang dihasilkan dari proses esterifikasi. Kemudian mencuci ester dengan 100ml aquades dengan mengocoknya sehingga terbentuk dua lapisan, lapisan atas adalah ester sedangkan lapisan bawah bening adalah air karne massa jenis air lebih berat jika dibandingkan dengan ester. Kemudian kami melakukan pencucian kembali menggunakan NaHCO3 bertujuan untuk mengikat pereaksi yang berlebih, dalam hal ini asam asetat glasial. Ketika membuang pengotor perlu berhati-hati agar ester yang berada dalam corong pisah tidak ikut terbuang. Selanjutnya, penambahan 6mg MgSO4 anhidrat untuk mengeringkan air, karena bersifat dapat menyerap air. MgSO4 tidak larut dalam ester, ketika disaring ester bening dan terdapat gumpalan.
Pada proses destilasi didapatkan n-butil asetat murni. Proses destilasi ini digunakan untuk memisahkan antara senyawa n-butil asetat yang merupakan produk utama dengan air atau dengan kata lain untuk mendapatkan n-butil asetat yang muri. Prinsip destilasi adalah penguapan cairan dan pengembunan kembali uap tersebut pada suhu titik didih. Titik didih yang diperoleh adalah berkisar 125C-130C dengan volume 9ml.
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum pembuatan ester dapat disimpulkan bahwa :
- Ester dapat dibuat dengan proses esterifikasi, dengan menggunakan n-butil alkohol dan asam asetat glasial.
- Pada prose esterifikasi dilakukan tahap refluks dan ekstraksi.
- Destilasi dapat dilakukan untuk memperoleh n-butil asetat murni.
- Diperoleh n-butil asetat sebanyak 9ml dengan titik didih 125C-130C.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Anshory, Irfan. 2003. Acuan Pelajaran Kimia. Jakarta: Erlangga
- Keenan, dkk. 1997. Kimia untuk Universitas. Jakarta: Erlangga
- Wardiyah. 2016. Kimia Organik. Jakarta: Kementrian Kesehatan Republik Indonesia.
