Laporan Praktikum Asidimetri – Berikut adalah laporan tentang Asidimetri yang kami susun berdasarkan berbagai refrensi sehingga Landasan Teori yang digabungkan lebih banyak, silahkan di baca.
BAB I PENDAHULUAN
A. Latar Belakang
Dalam kegiatan praktikum dilaboratorium, ketika hendak menentukan kadar suatu zat biasanya menggunakan metode titrasi. Titrasi merupakan proses penentuan konsentrasi suatu larutan dengan mereaksikan larutan yang sudah ditentukan konsentrasinya (larutan standar). Ada beberapa macam metode titrasi, seperti apabila ingin melakukan titrasi yang melibatkan reaksi asam basa suatu zat kita dapat menggunakan metode titrasi asidimetri. Metode ini terbilang cukup menguntungkan karena cukup mudah dan cepat untuk dilakukan. Selain itu titrasi asidimetri memiliki ketetapan dan ketelitian yang cukup tinggi, sehingga sering menjadi pilihan untuk melakukan mode titrasi asam basa.
Penetapan titrasi asidimetri dan alkalimetri acap kali digunakan untuk menentukan titrasi asam maupun basa suatu zat pada reaksi netralisasi asam dan basa dengan menggunakan indikator yang sesuai. Asidimetri merupakan analisis yang menggunakan asam sebagai larutan standar. Ketepatan pemilihan indikator dilakukan agar kesalahan titrasi dapat diminimalisasi sekecil mungkin. Indikator yang sering digunakan adalah indikator PP dan fenolftalein. Indikator yang dipilih adalah indikator yang cepat berubah pada invers pH sekitar titik ekuivalen. Titik akhit titrasi ditandai dengan timbulnya perubahan warna indikator yang ditambahkan. Untuk mengetahui keterangan lanjutan dari titrasi asidimetri maka dilakukan percobaan mengenai titrasi asidimetri.
B. Pembatasan Masalah
Pembatasan masalah dalam Laporan Praktikum Asidimetri ini adalah:
Agar pembatasan masalah dalam praktikum ini memiliki ruang lingkup yang jelas maka pembatasan masalahnya adalah “pembuatan larutan standar HCl 0,1 N; standarisas larutan HCl; dan prosedur standarisasi larutan.”
C. Rumusan Masalah
Rumusan masalah dalam Laporan Praktikum Asidimetri ini adalah :
- Bagaimana cara membuat larutan standar HCl 0,1N ?
- Bagaimana standarisasi larutan HCl ?
- Bagaimana prosedur standarisasi ?
- Berapa kadar NaOH yang diperoleh dari proses titrasi?
D. Tujuan Praktikum
Tujuan dari praktikum ini adalah :
- Dapat mengetahui cara membuat larutan standar HCl 0,1N
- Dapat mengetahui standarisasi larutan HCl
- Dapat mengetahui prosedur standarisasi
- Dapat mengetahui kadar NaOH yang diperoleh dari proses titrasi
BAB II KAJIAN PUSTAKA
Titrasi asam basa atau biasa disebut dengan asidi alkalimetri adalah reaksi netralisasi yaitu reaksi antara ion H+ (H3O+) dari asam dengan OH- dari basa yang akan membentuk air. titrasi asam dan basa antara sampel dengan larutan standar disebut analisis asidi – alkalimetri. Apabila larutan yang bersifat asam maka analisis yang dilakukan adalah analisis asidimetri. Sebaliknya jika digunakan suatu basa sebagai larutan standar, analisis tersebut disebut sebagai analisis alkalimetri (Keenan, 1991).
Larutan standar adalah larutan yang konsentrasinya sudah diketahui secara pasti. Berdasarkan kemurniannya larutan standar dibedakan menjadi larutan standar primer dan larutan standar sekunder. Larutan standar primer adalah larutan standar yang dipersiapakan dengan menimbang dan melarutkan suatu zat tertentu dengan kemurnian tinggi (konsentrasi diketahui dari massa – volum larutan). Larutan standar sekunder adalah larutan standar yang dipersiapakan dengan menimbang dan melarutkan suatu zat tertentu dengan kemurnian relatif rendah sehingga konsentrasi diketahui dari hasil standarisasi (Underwood, 1999: 67).
Syarat senyawa yang dapat dijadikan larutan standar primer :
- Memiliki kemurnian 100%
- Bersifat stabil pada suhu kamar dan stabil pada suhu pemanasan karena standar primer biasa dipanaskan terlebih dahulu sebelum ditimbang
- Memiliki berat molekul (Mr) yang tinggi, hal ini untuk menghindari kesalahan relative pada saat menimbang. Menimbang dengan berat yang besar akan lebih mudah dan dapat meminimalisasi kesalahan.
- Mudah didapatkan
Larutan standar sekunder adalah larutan yang konsentrasinya diperoleh dengan cara mentitrasi dengan larutan standar primer. NaOH tidak dapat dipakai untuk standar primer karena NaOh bersifat higroskopis, oleh sebab itu NaOH harus dititrasi terlebih dahulu dengan KHP agar dapat dipakai sebagi standar primer
BAB III METODE PRAKTKUM
A. Waktu dan Tempat
Praktikum asidimetri ini kami lakukan pada:
Hari:
Tempat:
B. Alat dan Bahan
Alat
- kaca arloji
- neraca
- botol timbang
- labu ukur 100 ml
- labu ukur 250 ml
- erlenmeyer 250 ml
- corong
- batang pengaduk
- pipet gondok
- pipet tetes
- buret 50 ml
- statif dan klem
Bahan
- HCl pekat
- aquades
- Na2B4O7.10H2O
- Indikator MM
- NaOH
C. Prosedur Kerja atau Cara Kerja
a. Membuat larutan strandar HCl
- Pipet 2 ml HCl ke dalam labu ukur 250 ml
- Tambahkan aquade hingga tanda batas, tutup botol dan homogenkan
b. Standarisasi larutan HCl dengan boraks
- Timbang 9,55 gr boraks, larutkan dengan aquades ke dalam labu ukur 250 ml
- Pipet 25 ml larutan boraks ke dalam erlenmeyer
- Tambahkan 2 tetes indikator MM, titrasi dengan HCl hingga warna menjadi merah muda
c. Penetapan kadar NaOH
- Ditimbang 0,01 gr kristal NaOH, dilarutkan dengan aquades ke dalam labu takar 100 ml
- Dipipet 10 ml larutan NaOH ke dalam erlenmeyer
- Tambahkan 2 tetes indikator MM, titrasi denga HCl hingga warna menjadi merah muda
BAB IV HASIL DAN PEMBAHASAN
Adapun pembahasan dalam laporan praktikum asidimetri ini adalah sebagai berikut :
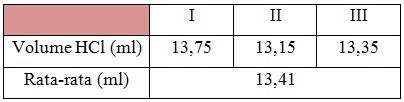
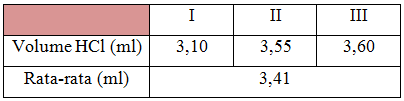
Pada percobaan asidimetri ini, digunakan boraks (Na2B4O7.10H2O) 0,1N sebagai larutan standar primer, HCl sebagai larutan standar sekunder, dan Metil Merah sebagai indikator. Sampel yang akan ditentukan konsentrasi atau kadarnya adalah senyawa basa kuat yaitu natrium hidroksida atau soda kaustik (NaOH).
Percobaan dimulai dari pembuatan larutan standar HCl, degan cara memipet larutan HCl pekat sebanyak 2 ml, kemudian memasukkan larutan pekat tersebut ke dalam labu ukur 250 ml. Larutan HCl pekat yang telah berada dalam labu ukur kemudian ditambahkan aquades hingga tanda batas labu, larutan kemudian dikocok agar menjadi homogen. Selain pembuatan larutan standar HCl, juga dilakukan pembuatan larutan standar boraks, yang berfungsi sebagai larutan standar primer. Hal ini bertujuan untuk menentukan konsentrasi dari larutan standar HCl. Prosedur standarisasi menggunakan metode titrasi. Larutan boraks yang telah dibuat dimasukkan sebanyak 25 ml ke dalam erlenmeyer. Kemudian ditambahkan 2 tetes indikator metil merah, dan dititrasi dengan HCl. Proses titrasi dilakukan sebanyak 3 kali, untuk mengurangi kesalahan dalam pengukuran serta mendapatkan nilai yang lebih akurat. Volume rata-rata HCl diperoleh sebanyak 13,41 ml. Dari proses standarisasi HCl maka diperoleh normalitas HCl dari perhitungan sebesar 1,5 x 10^-4 N. Maka HCl siap dijadikan titrat untuk menentukan kadar NaOH.
Reaksi dari proses standarisasi HCl dengan boraks :
Na2B4O7.10H2O + 2HCl→ 4H3BO3 + 2NaCl + 5H2O
Penentuan kadar NaOH, dimulai dari pembuatan larutan NaOH, sebanyak 0,01 gr kristal NaoH dilarutkan dalam labu takar 100 ml hingga tanda batas. Kemudian dilanjutkan dengan metode titrasi, NaOH sebanyak 10 ml dimasukkan ke dalam erlenmeyer sebagai titran, kemudian ditambahkan indikator metil merah. HCl dimasukkan kedalam buret dengan menggunakan corong kaca, agar larutan HCl tidak tumpah. Perhitungan kadar dapat menggunakan rumus :
% (b/v) sampel = N x BM x (10/100) 100%
Dari perhitungan diperoleh kadar NaOH sebesar 0,16%. Reaksi dari proses titrasi asidimetri ini adalah :
NaOH + HCl→ NaCl + H2O
Reaksi metil merah ketika ditambahkan kedalam NaOH
NaOH + C15H15N3O2 → C15H14N3O2 + H2O + Na
BAB V PENUTUP
Kesimpulan
- Pembuatan larutan standar HCl dilakuka dengan cara HCl pekat, larutan HCl yang sudah diencerkan dilakukan standarisasi terlebih dahulu dengan larutan standar primer boraks agar dapat digunakan sebagai larutan standar, yang disebut larutan standar sekunder.
- Dari proses standarisasi HCl dengan larutan boraks diperoleh normalitas sebesar 1,5 x 10^-4
- Dari percobaan titrasi asidimetri diperoleh kadar NaOH sebesar 0,16%.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Day, R.A. & Underwood, A.L. 1999. Analisis Kimia Kuantitatif Edisi 6.
Erlangga. Jakarta. - Keenan, C.W. dkk. 1991. Ilmu Kimia Untuk Universitas. Jakarta, Erlangga.
