Laporan Praktikum Pembuatan Larutan dan Pengenceran, Pembuatan Larutan dan Pengenceran NaCl, NaOH, C11H22O11 diserta Teori Lengkap. Laporan Berikut ini merupakan laporan yang admin Laporanpraktikum.id susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
A. Latar Belakang
Laturan memgang peran penting dalam kehidupan sehari-hari. Misalnya saja makhluk hidup menyerap vitamin, mineral, dan makanan dalam bentuk larutan. Reaksi kimia di alam dan di laboratorium kebanyakan berlangsung tidak dalam bentuk senyawa murni, melainkan dalam bentuk larutan. Untuk pembuatan larutan pada umumnya digunakan pelarut air. Namun ada juga yang menggunakan pelarut selain air.
Larutan merupakan campuran homogen yang komposisinya sama, ukuran partikel, tidak ada bidang batas antara zat pelarut dengan zat terlarut yang artinya tak bisa dibedakan secara langsung antara zat pelarut dengan zat terlarut, partikel penyusunnya berukusan sama dari dua zat atau lebih. Dalam pembentukan larutan apabila zat padat atau cair larut dalam cairan, maka dalam campuran terjadi gaya tarik menarik antar molekul (intermolekul) zat terlarut dan pelarut. Selain itu juga terdapat gaya tarik dai dalam molekul (intramolekul) itu sendiri yang menyebabkan molekul atau ionnya masih tetap bersatu.
Pembuatan larutan ini sangat penting karena larutan sering kali digunakan sebagai reagen atau pereaksi. Pembuatan larutan juga didasari untuk pembuatan larutan standar atau larutan pereaksi. Selain itu pembuatan larutan bertujuan untuk membuat larutan yang baru dan menggantikan larutan yang lama atau yang telah kadaluarsa (tidak layak pakai).
dalam Praktikum Pembuatan Larutan, Di dalam larutan terdapat kuantitas relatif suatu zat tertentu yang disebut konsentrasi. Konsentrasi larutan menyatakan banyaknya zat terlarut yang terdapat dalam suatu pelarut atau larutan. Larutan yang mengandung sebagian besar solut relatif terhadap pelarut, berarti larutan tersebut konsentrasinya tinggi atau pekat. Sebaliknya bila mengandung sejumlah kecil solut, maka konsentrasinya rendah atau encer. Larutan pekat dapat dibuat menjadi encer dengan proses pengenceran.
B. Pembatasan Masalah
Pembatasan masalah dalam laporan ini adalah:
Agar pembatasan masalah dalam praktikum ini memiliki ruang lingkup yang jelas maka pembatasan masalahnya adalah
C. Rumusan Masalah
Rumusan masalah dalam praktikum ini adalah :
- Bagaimana cara membuat larutan dengan berbagai macam konsentrasi?
- Bagaimana cara mengencerkan larutan dengan berbagai konsentrasi?
D. Tujuan Praktikum
Tujuan praktikum ini adalah :
- Mengetahui cara membuat larutan dengan berbagai macam konsentrasi.
- Mengetahui cara mengencerkan larutan dengan berbagai konsentrasi.
BAB II KAJIAN PUSTAKA
Kajian pustaka dala Praktikum Pembuatan Larutan ini dimulai dari pengertian larutan, dimana larutan adalah campuran homogen antara zat terlarut dan pelarut. Larutan terdiri atasdua komponen, komponen utama biasanya disebut pelarut, dan komponen minornyadinamakan zat terlarut. Pelarut dipandang sebagai pembawa atau medium bagi zat terlarut,yang dapat berperan serta dalam reaksi kimia dalam larutan atau meninggalkan larutankarena pengendapan atau penguapan (Oxtoby, 2001).
Pada umumnya zat yang digunakan sebagai pelarut adalah air (H2O), selain air yang berfungsi sebagai pelarut adalah alcohol, amoniak, kloroform, benzena, minyak, asam asetat, akan tetapi kalau menggunakan air biasanya tidak disebutkan (Gunawan, 2004).
Larutan gas dibuat dengan mencampurkan sutu gas dengan gas lainnya. Karena smeua gas bercampur dalam semua perbandingan, maka setiap campuran gas adalah homogen ia merupakan larutan. Larutan cairan dibuat dengan melarutkan gas, cairan atau padatan dalam suatu cairan. Apabila sebagian cairan adalah air, maka larutan disebut larutan berair. Larutan padatan adalah padatan-padatan dalam mana satu komponen terdistribusi tak beraturan pada atom atau molekul dari komponen lainnya (Syukri, 1999).
Untuk menyatakan komposisi larutan secara kuantitatif digunakan konsentrasi. Konsentrasi didefinisikan sebagai jumlah zat terlarut dalam setiap satuan larutan atau pelarut, dinyatakan dalam satuan volume (berat, mol) zat terlarut dalam sejumlah volume (berat , mol) tertentu dari pelarut. Berdasarkan halini muncul satuan-satuan konsentrasi, yaitu fraksi mol, molaritas, molalitas, normalitas, ppm serta ditambah dengan persen massa dan persen volume (Baroroh, 2004).
Pengenceran adalah mencampur larutan pekat (konsentrasi tinggi) dengan cara menambahkan pelarut agar diperoleh volume akhir yang lebih besar. Jika suatu senyawa kimia yang pekat diencerkan, kadang-kadang sejumlah panas dilepaskan. Hal ini terutama terjadi pada pengenceran asam sulfat pekat (H2SO4). Agar panas ini dapat dihilangkan dengan aman, asam sulfat pekat yang harus ditamahkan dalam air, tidak boleh sebaliknya. Jika air ditambahkan ke dalam asam sulfat pekat, panas yang dilepaskan sedemikian besar dapat menyebabkan air mendadak mendidih dan menyebabkan asam sulfat memercik (Khopkar, 1990).
Rumus pengenceran menurut (Gunawan, 2004) yaitu :
M1 V1 = M2 V2
Keterangan :
M1 = molaritas awal larutan
M2 = molaritas akhir larutan
V1 = volume awal larutan
V2 = volume akhir larutan
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum pembuatan larutan ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Alat
- gelas ukur
- gelas kimia 50ml
- kaca arloji
- botol semprot
- corong kaca
- pipet ukur
- tabung reaksi
- batang pengaduk
- neraca
- labu volumetrik 100ml
Bahan
- Aquades
- NaOH
- C11H22O11
- NaCl
C. Prosedur Kerja atau Cara Kerja
a. Membuat larutan NaCl 0,1M; NaOH 0,02M; C11H22O11 0,02M
- Hitung massa kristal NaCl, NaOH, dan C11H22O11 dari data yang ada
- Timbang masing-masing kristal NaCl, NaOH, dan C11H22O11 menggunakan kaca arloji dan necara
- Masukkan masing-masing kristal pada gelas kimia 50ml, semprot kaca arloji kedalam gelas kimia, tambahkan aquades hingga 25ml
- Pindahkan masing-masing larutan kedalam labu ukur 100ml yang berbeda dengan bantuan corong kaca, bilas gelas kimia dan corong kaca kedalam labu ukur agar tidak ada zat yang tertinggal
- Bilas dinding labu ukur, tambahkan aquades hingga tanda batas
- Tutup labu ukur dan homogenkan larutan.
b. Membuat larutan dengan pengenceran
- Pipet masing-masing larutan dari percobaan pertama sebanyak 10ml menggunakan pipet ukur dan masukkan kedalam labu volumetrik 100ml yang berbeda
- Tambahkan aquades hingga tanda batas
- Hitung konsentrasi setelah pengenceran
BAB IV HASIL DAN PEMBAHASAN
Adapun pembahasan dalam Praktikum Pembuatan Larutan ini adalah sebagai berikut :
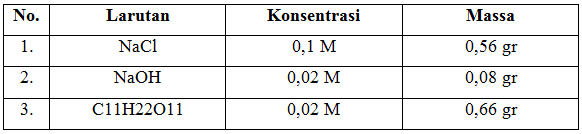

Pada praktikum kali ini ada dua percobaan yang dilakukan. Percobaan pertama mengenai pembuatan larutan. Percobaan kedua adalah mengenai pengenceran larutan. Untuk membuat suatu larutan dengan konsentrasi yang diinginkan atau sudah ditetapkan, maka perlu diketahui berapa massa krital yang di perlukan. Ada 3 kristal yang digunakan yakni, NaCl, NaOH, C11H22O11. Untuk mendapatkan massa kristal dapat dengan dicara cara teoritis yakni menggunakan rumus molaritas yakni, perbandingan massa dengan massa atom relative zat dikalikan dengan 1000 berbanding volume yang akan dicapai. Setelah dicari massa kristal secara teoritis didapat massa masing-masing krital yaitu NaCl 0,56 gr; NaOH 0,08 gr; C11H22O11 0,66 gr.
Dalam pembuatan larutan perlu menggunakan ketelitian yang tinggi karena jika terjadi kesalahan yang kecil saja larutannya tidak akan menjadi larutan yang diinginkan. Maka dari itu pada pembuatan larutan terdapat proses pencucian, karena dikhawatirkan terdapat zat yang tertinggal.
Percobaan kedua mengenai pengenceran. Proses pengenceran merupakan proses pencampuran larutan pekat dengan cara menambahkan pelarut sehingga didapatkan volume akhir yang lebih besar dengan konsentrasi yang lebih kecil dari sebelumnya. Percobaan pengencenran ini menggunakan ketiga larutan yang telah dibuat pada percobaan pertaman mengenai pembuatan larutan. sebanyak 10ml larutan NaCl, NaOH, C11H22O11 dipipet untuk dimasukkan pada labu volumetrik 100ml yang berbeda. Maka setelah dilakukan pengenceran didapatlah hasil konsentrasi masing-masing larutan yakni, NaCl 0,01 M; NaOH 0,002 M; C11H22O11 0,002M. Konsentrasi yang didapat sesuai dengan teori pengenceran yakni konsentrasi akhir larutan menjadi lebih kecil.
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dapat disimpulkan bahwa :
- Untuk membuat larutan dengan berbagai konsentrasi sesuai dengan yang diinginkan maka perlu diketahui massa kristal yang ingin dibuat, dalam praktikum ini adalah kristal NaCl, NaOH, C11H22O11. Setelah dicari massa kristal secara teoritis didapat massa masing-masing krital yaitu NaCl 0,56 gr; NaOH 0,08 gr; C11H22O11 0,66 gr.
- Pengenceran larutan dapat dilakukan dengan menambahakan aquades sesuai dengan volume yang dibutuhkan, dalam praktikum ini adalah 100ml aquades. Setelah dilakukan pengenceran didapatlah hasil konsentrasi masing-masing larutan yakni, NaCl 0,01 M; NaOH 0,002 M; C11H22O11 0,002M.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Baroroh, Umi L.U. 2004. Diktat Kimia Dasar 1. Banjar Baru: Universitas Lambung Mangkurat.
- Gunawan, Adi dan Roeswati. 2004. Tangkas Kimia. Surabaya: Kartika.
- Khopkar, S.M. 1990. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia.
- Oxtoby, David W. dkk. 2001. Prinsip-Prinsip Kimia Modern, Ed. Ke4. Jilid. 1. Jakarta: Erlangga.
- Syukri, S. 1999. Kimia Dasar 2. Bandung: ITB
