Tata nama senyawa kimia sesuai dengan aturan IUPAC memang cukup rumit. Akan tetapi, sebenarnya aturan ini dibuat untuk mempermudah membedakan antara satu senyawa dengan yang lain. Dengan adanya penamaan ini juga mampu mencegah salah pemberian nama atau penyebutan senyawa kimia.
Dalam penamaan senyawa kimia dibedakan menjadi tata nama senyawa anorganik dan tata nama senyawa organik. Keduanya memiliki aturan yang berbeda, salah satunya karena struktur senyawa yang dimiliki. Seperti apakah aturan penamaan senyawa sesuai International Union of Pure Applied Chemistry tersebut?
Tata Nama Senyawa Anorganik
Senyawa anorganik adalah senyawa yang berasal dari mineral, dan tidak memiliki atom karbon. Tahukah kalian bahwa senyawa ini bisa dibentuk dari bermacam-macam unsur baik logam dan non logam.
Dalam aturan tata nama senyawa kimia dan lambangnya dibedakan menjadi 3 bagian. Pertama mulai dari senyawa ion yang terdiri dari kation dan anion, senyawa molekul dan terakhir senyawa asam.
Senyawa Ion

Sumber :https://i.ytimg.com/vi/EIAaGHK5pjA/maxresdefault.jpg
Senyawa ion yang terdiri dari unsur logam dan memiliki lebih sedikit elektron daripada proton disebut dengan kation. Sementara untuk senyawa yang memiliki lebih banyak elektron daripada proton disebut dengan anion.
1. Anion
Sebuah anion seperti sudah disebutkan di atas memiliki lebih banyak jumlah elektron jika dibandingkan dengan protonnya. Hal ini menyebabkan ion bermuatan negatif, kebalikan dari kation yang bermuatan positif.
Anion bisa terjadi apabila suatu atom berhasil menarik satu atau lebih elektron dan membuat jumlah elektron lebih banyak.
Dalam penamaan anion sesuai dengan tata nama senyawa menurut IUPAC dibedakan menjadi anion monoatom dan poliatom. Keduanya dibedakan dari segi berapa jumlah unsur yang membangun suatu ion.
Untuk anion poliatomik, maka ion yang ada dihasilkan dari 2 jenis atom yang berbeda atau bisa juga lebih. Contoh dari anion poliatomik misalnya ion nitrat, atau ion sulfit.
Sedangkan untuk anion monoatomik merupakan ion yang berasal dari hanya sejenis unsur saja. Contoh yang mudah dari anion monoatomik misalnya ion natrium, ion florida, ion hidrida, dan ion nitrida.
a. Anion Poliatomik
Dalam tata nama senyawa poliatomik kalian bisa menandainya dengan akhiran -it atau -at pada bagian belakang. Untuk akhiran -at digunakan pada unsur yang memiliki atom oksigen lebih banyak. Sementara untuk unsur dengan akhiran -it, artinya ia memiliki atom, oksigen yang jumlahnya lebih sedikit.
Contohnya = NO2– yang disebut dengan ion nitrit dan NO3– disebut dengan ion nitrat. Sementara SO42– dinamakan dengan ion sulfat dan SO32– disebut dengan ion sulfit.
b. Anion Monoatomik
Apabila poliatomik menggunakan akhiran -it atau -at, maka untuk monoatomik akhiran yang digunakan adalah -ida. Aturan penamaan untuk monoatomik ini hanya terdiri dari satu jenis akhiran saja. Sehingga kalian bisa memberikan nama dengan benar lebih mudah.
Misalnya saja ion hidrida ( H- ), ion nitrida ( N3– ), atau ion fluorida ( F- ), sama sekali tidak ada perbedaan pada akhirnya bukan?
Selain dari 2 penamaan tersebut masih ada satu penamaan spesial yaitu aninon yang diturunkan dari tambahan H+. Untuk menamainya kalian hanya tinggal menambahkan hidrogen di depan senyawa. Misalnya untuk HCO3-, maka kalian menamainya dengan hidrogen karbonat.
2. Kation
Ion kation memiliki lebih sedikit jumlah elektron daripada proton yang membuat muatannya menjadi positif. Hal ini terjadi ketika sebuah senyawa kehilangan satu, dua, atau lebih elektron.
Konsepnya memang terbalik ya, biasanya kalian menganggap kehilangan sesuatu adalah hal positif bukan? Nah, untuk konsep kation hal ini berbeda karena elektron sendiri muatannya negatif. Sehingga saat elektron itu hilang maka muatan menjadi positif.
Dalam penamaan kation, ada 3 aturan yang harus kalian perhatikan, aturan tersebut adalah :
Penamaan Sesuai Unsur Logam
Aturan penamaan yang pertama adalah senyawa ion dinamai sesuai dengan unsur logamnya. Misalnya saja seperti ion natrium karena terdiri dari Na+ , dan ion kalsium yang terdiri dari Ca2+ , serta Ag+ yang disebut ion perak.
1. Nama dituliskan dengan Angka Romawi
Aturan ini digunakan apabila logam yang dimaksud bisa membentuk lebih dari satu kation namun, muatannya berbeda. Penggunaan angka romawi ini cukup mudah, kalian hanya perlu menaruh angka romawi di dalam kurung.
Contohnya seperti yang terjadi pada ion besi, Fe2+ disebut dengan ion besi( III ), sedangkan ion besi, Fe3+ dinamai ion besi(III).
Dalam menulis angka romawi, pastikan kalian selalu menempatkannya di dalam kurung ya. Lalu pastikan antara tanda kurung dan penulisan nama ion tidak diberi spasi melainkan, tulis langsung di sampingnya seperti contoh di atas.
2. Pemberian Akhiran -um
Akhiran -um diberikan pada kation yang memiliki unsur bukan logam, penamaanya mirip dengan anion. Kalian cukup menambahkan -um saja dibelakang nama unsur.
Contohnya, NH4+ maka nama senyawa ion yang betul adalah ion amonium, sementara untuk H3O+ disebut dengan ion hidronium. Sangat mudah bukan cara penamaannya?
Senyawa Molekul
Penamaan senyawa molekul diberikan kepada unsur dengan ion bukan logam seperti hidrogen fluorida atau hidrogen sulfida. Untuk tata cara pemberian nama ini ada 4 cara penamaan yang berbeda-beda, cukup banyak ya?
1. Nama Unsur Ditulis Lebih Dahulu
Nama unsur ditulis terlebih dahulu apabila letaknya ada pada sebelah kiri tabel periodik. Apabila kalian masih belum hafal tabel periodik, usahakan selalu membawanya ya, supaya tidak salah saat menamai senyawa molekul ini.
Ada satu kondisi dimana aturan bisa tidak berlaku, hal ini apabila senyawa mengandung unsur halogen kecuali fluorin. Penulisan unsurnya dipindah pada bagian belakang dan bukannya depan. Unsur halogen yang dimaksud ada 3 yaitu oksigen, klorin, serta iodin.
2. Apabila Unsur Pada Golongan yang Sama
Tata cara penamaan untuk unsur yang berada pada golongan yang sama yaitu bergantung dari letak unsur di tabel periodik. Apabila letaknya ada di bagian bawah, maka nama unsur disebut terlebih dahulu. Sedangkan jika nama unsur ada di bagian atas maka unsur disebut terakhir.
3. Pemberian Akhiran -ida
Pemberian akhiran -ida juga berlaku untuk senyawa molekul seperti yang terjadi pada hidrogen fluorida. Pemberian ida ini jangan sampai tertukar dengan unsur yang lain ya.
4. Berdasarkan Jumlah Atom yang Dimiliki
Jumlah atom yang dimiliki sebuah unsur bisa digunakan untuk menentukan bagian depan bahasa Yunani. Contoh yang paling mudah misalnya dinitrogen monoksida yang digunakan untuk menamai 2 atom nitrogen.
Tata Nama Senyawa Asam
Sumber : https://f0.pngfuel.com/png/513/267/acid-chemical-compound-chemical-formula-structure-molecule-1-2-moonlight-png-clip-art.png
Definisi asam sendiri bisa diartikan dengan berbagai istilah yang berbeda-beda. Salah satu yang sering digunakan adalah senyawa yang memiliki paling tidak satu atau lebih atom hidrogen dan menghasilkan ion H+ ketika larut dalam air.
Untuk tata nama senyawa asam pada awal selalu dimulai dengan kata “asam”, baru kemudian diikuti dengan unsur yang lain. Contoh yang paling mudah adalah HF maka kita sebut dengan asam fluorida, lalu NO2 maka namanya adalah asam nitrit.
Jika kalian menyadari, tetap ada akhiran at, ida, dan juga it pada penamaan asam di atas bukan? Nah, aturan untuk menentukan akhiran yang digunakan sama dengan pada anion yang sudah dibahas di atas.
Pembahasan mengenai bagaimana penamaan pada senyawa anorganik di atas sudah selesai. Mulai dari bagaimana tata nama untuk senyawa ion, molekul, dan asam semuanya sudah dibahas sesuai dengan standar IUPAC.
Contoh yang dibutuhkan juga bisa kalian lihat pada masing-masing bagian pembahasan. Nah, karena bagian anorganik sudah selesai, saatnya membahas bagaimana tata nama untuk senyawa organik.
Tata Nama Senyawa Organik
Sumber : https://pixfeeds.com/images/14/383874/1200-497585559-urea-molecule.jpg
Tata nama senyawa organik tidak terlalu sulit untuk dipelajari. Dasarnya kalian harus mengetahui bahwa inti dari penamaan ini adalah menghitung jumlah karbon yang dimiliki.
Dalam cara penamaan senyawa organik ada 7 tata nama yang harus kalian pelajari. Pertama adalah alkana, alkena, dan alkuna, kemudian alkohol, aldehida, eter, keton, asam karboksilat, dan eter.
1. Alkana, Alkena, Alkuna
Dari alkana, alkena, dan alkuna berbeda pada jenis ikatan rangkap dari sebuah karbon dengan karbon lain.
A. Alkana
Untuk alkana terdapat 12 jenis rantai karbon, mulai dari metana hingga dodekana yang memiliki 12 atom karbon. Semua rantai karbon tersebut merupakan ikatan rantai tunggal. Untuk selengkapnya bisa kamu simak pada tabel di bawah ini :
| Jumlah Karbon | Nama |
| 1 | Metana |
| 2 | Etana |
| 3 | Propana |
| 4 | Butana |
| 5 | Pentana |
| 6 | Hexana |
| 7 | Heptana |
| 8 | Oktana |
| 9 | Nonana |
| 10 | Dekana |
| 11 | Oktadekana |
| 12 | Dodekana |
Contoh pengaplikasian nama alkana misalnya : CH3 – CH3 – CH3 – CH3 maka senyawa alkana ini disebut dengan n- butana.
Untuk penamaan alkana rantai bercabang, tetap menggunakan rujukan tabel di atas. Hanya saja, kini nama senyawa secara lengkap ditambahkan dengan nama rantai yang ada.
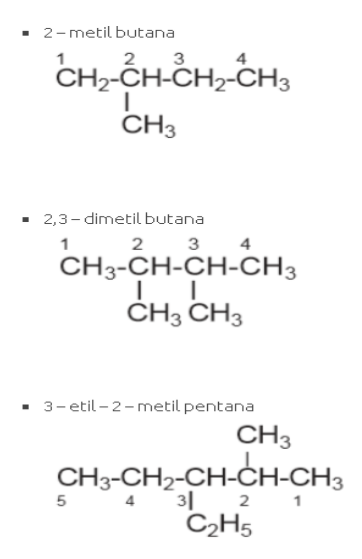
Sumber :sumberbelajar.com
Gambar di atas merupakan contoh bagaimana penamaan alkana dengan rantai. Penomoran yang digunakan menggunakan dasar nomor romawi yang diurutkan secara alfabetis.
B. Alkena
Perbedaan mendasar dari alkena dan alkana ada pada jumlah rantai karbon yang dimiliki. Jika pada alkena, jumlah rantai yang digunakan ada yang memiliki rantai karbon ganda. Untuk penamaan nomornya, tetap sama dengan cara penamaan yang digunakan oleh alkana, hanya saja rumus struktur yang dimiliki berbeda.
Kalian bisa melihat bagaimana deret alkana, rumus molekul, serta struktur yang dimiliki oleh alkana di bawah ini :
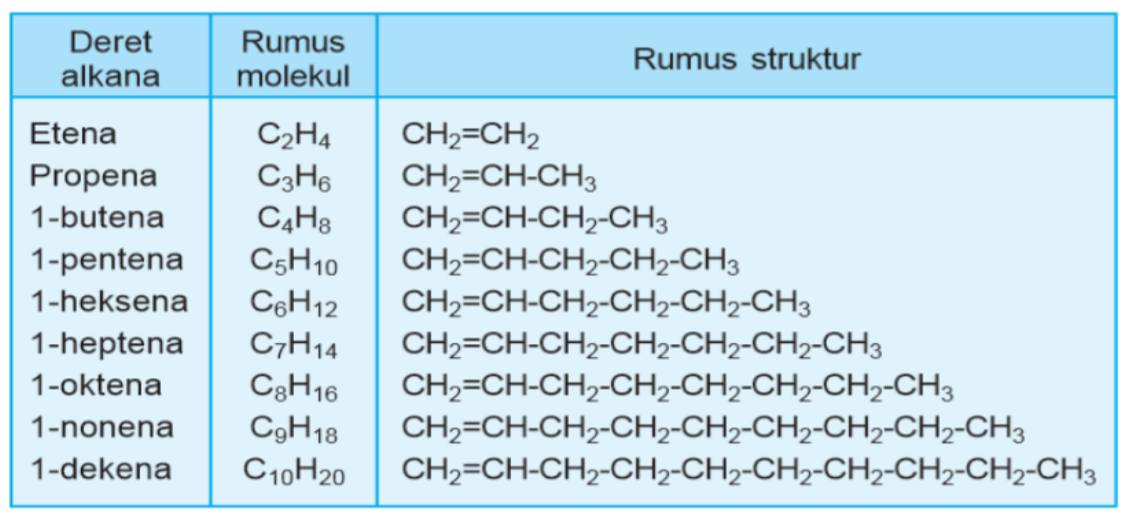
Sumber :sumberbelajar.com
Seperti yang kalian bisa lihat di atas, terdapat unsur karbon yang memiliki rantai ganda. Di sinilah letak perbedaan yang paling besar, sedangkan untuk penamaanya masih tetap sama.
C. Alkuna
Apabila alkana memiliki satu rantai, alkena dua rantai, maka alkuna memiliki 3 ikatan karbon. Untuk penamaan, alkuna juga sama seperti alkena, yaitu masih menggunakan alkana sebagai acuan. Perbedaannya hanya terdapat di rumus strukturnya seperti di bawah ini :
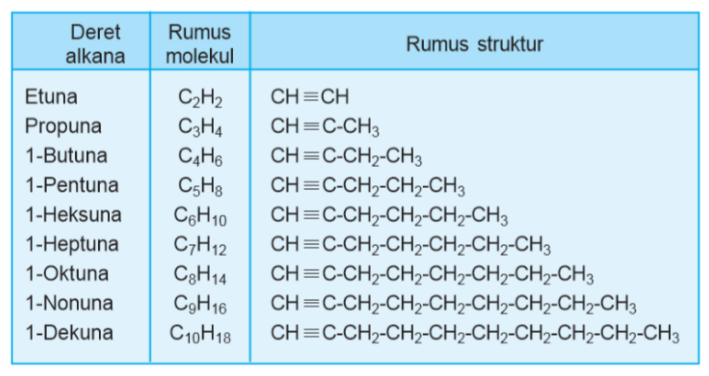
Sumber :sumberbelajar.com
2. Alkohol
Tata nama alkohol tetap bergantung pada jumlah rantai karbon yang ada. Perbedaannya, disini gugus hidroksil yang terkandung di dalam rantai karbon juga dihitung. Penamaan senyawa alkohol masih sama seperti alkana, hanya urutannya dan akhirannya berbeda.
Untuk penamaannya menggunakan urutan : nomor cabang – nama alkil -nomor OH – rantai utama. Sedangkan akhiran yang digunakan adalah -diol sesuai standar yang digunakan oleh IUPAC.
3. Eter
Nama lain dari eter adalah alkoksialkana dengan gugus -OR yang bisa dibagi menjadi dua gugus alkil. Untuk eter, yang menjadi rantai induk adalah gugus alkilnya, sedangkan penomorannya memprioritaskan atom karbon yang mengikat -OR.
4. Aldehida
Aldehida merupakan senyawa yang memiliki rumus ikatan karbon -CHO. Untuk menentukan mana yang menjadi rantai utama, digunakan gugus yang mengandung -CHO terbanyak.
Untuk aldehida, pada akhir penamaanya diberi tambahan -al, misalnya propanal, butana, atau 2,4 dimetilopentanal. Penambahan -al ini juga karena aldehida sering disebut dengan alkanal yang memiliki rumus CnH2nO.
Untuk mengetahui seperti apa penamaan dan rumus bangunnya, kalian bisa melihat tabel di bawah ini :

5. Keton
Keton adalah senyawa dengan rumus CnH2nO dan memiliki senyawa karbon dengan gugus -CO-. Untuk menentukan mana yang akan menjadi rantai induk, kalian bisa mencari mana gugus yang memiliki -CO- dengan rantai terpanjang.
Untuk penamaannya, kalian harus mengganti huruf -a pada akhir menjadi -on. Contohnya dari pentana maka menjadi pentanon, dari butana menjadi butanon, dan dari propanol menjadi propanon.
6. Asam Karboksilat
Asam karboksilat juga disebut dengan asam alkanoat yang memiliki gugus -COOH dengan rumus CnH2nO2. Untuk penamaanya akhiran -a diganti dengan -oat misalnya saja butana menjadi butanoat, pentana kemudian berubah menjadi pentanoat.
Dalam penamaan rantai utama ditentukan berdasarkan mana cabang yang memiliki gugus -COOH paling banyak. Kemudian untuk penomoran atom karbon harus selalu digunakan sebagai awal penamaan.
7. Ester
Ester memiliki nama lain alkil alkanoat yang membuat akhiran -a diubah menjadi -oat. Dari propana kemudian menjadi propanoat, metana berubah menjadi metanoat, dan etana menjadi etanoat.
Gugus karbon dari ester adalah -COOR dengan rumus umum CnH2nO2. Penamaan ester sendiri mengikuti tata cara penamaan gugus alkanoat dan persis sama.
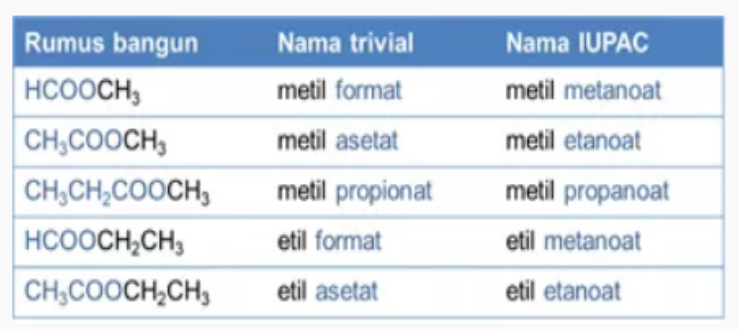
8. Alkil Halida
Alkil halida disebut juga dengan haloalkana karena terdiri dari senyawa halogen seperti F, Cl, Br, dan I. Rumus umum dari alkil halida adalah CnH2n+X dan rumus gugus alkilnya adalah R-X.
Untuk menentukan mana rantai utama sangat mudah, mirip dengan senyawa yang lain. kalian hanya perlu mencari rantai dengan cabang yang paling banyak mengandung atom halogen.
Dalam penamaan, apabila ada lebih dari satu atom halogen maka pilih mana atom yang paling reaktif. Atom yang paling reaktif ini harus dijadikan prioritas ketika kalian akan memberikan nomor saat penamaan senyawa.
Untuk penamaan senyawa organik memang lebih sulit daripada senyawa anorganik. Akan tetapi, kamu pasti bisa menguasainya asal memahami dasar tata cara penamaan yang benar sesuai IUPAC.
FAQ Seputar Tata Nama Senyawa
Dari pembahasan mengenai cara penamaan senyawa yang sudah di ulas di atas, biasanya ada yang sering ditanyakan. Nah, pertanyaan-pertanyaan yang paling sering ditanyakan tersebut akan diulas di bawah ini :
Kalian juga bisa menandainya dari letak atau posisi unsur pada tabel periodik. Untuk logam alkali serta alkali tanah pada akhirnya akan membentuk kation, sementara halogen menghasilkan anion. Dari semua penjelasan di atas apakah kalian sudah bisa memahami tata nama senyawa anorganik dan organik sesuai IUPAC? Apabila belum, mempelajarinya dari visualisasi dan suara mungkin bisa membantu. Seperti misalnya mempelajari lebih jauh dari video berikut