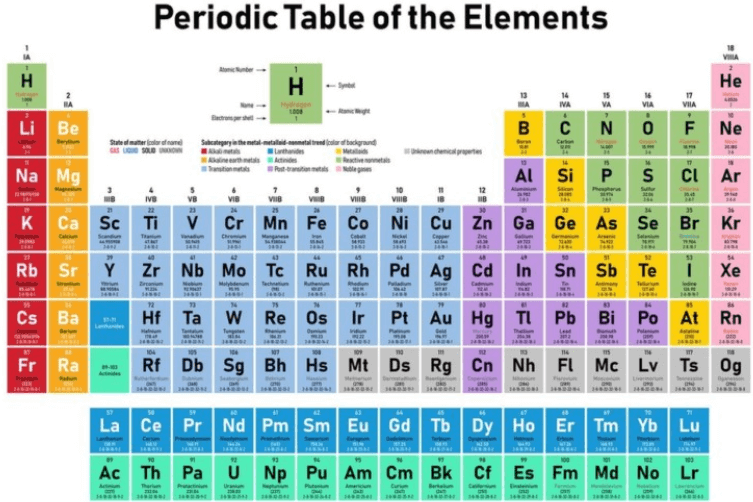
Deskripsi: Sistem periodik unsur akan mengelompokkan unsur-unsur berdasarkan nomor atom dan kemiripan sifat. Pada sistem ini juga ditemukan sifat keperiodikan suatu unsur.
Seperti yang kalian tahu, unsur-unsur yang ada di alam ini sangatlah banyak. Untuk mempermudah pengklasifikasian unsur-unsur tersebut, maka dibuatlah tabel sistem periodik unsur. Dinamakan “periodik” karena memiliki pola kesamaan sifat unsur yang terdapat pada susunan tersebut.
Penggolongan sistem periodik unsur ini berkaitan erat dengan konfigurasi elektron masing-masing atom. Dalam konfigurasi elektron suatu atom, kalian dapat melihat periode dan golongan dari unsur-unsur tersebut. Nah, periode dan golongan inilah yang menjadi dasar pengelompokan suatu unsur dalam tabel periodik.
Pengelompokan Unsur-Unsur
Pengertian sistem periodik unsur ini mengarah pada susunan dari unsur-unsur yang diurutkan berdasarkan nomor atom dan juga kemiripan sifat. Pengelompokan unsur dalam sistem periodik unsur ini nantinya didasarkan pada golongan, periode, blok, dan sifat logam, nonlogam, atau metaloid.
Unsur-unsur dengan elektron valensi sama akan ditempatkan pada golongan yang sama. Sementara itu, periode suatu unsur akan menunjukkan jari-jari atom, afinitas elektron, energi ionisasi, dan juga keelektronegatifan.
Lalu, unsur-unsur dengan subkulit elektron valensi yang sama, akan dikelompokkan dalam blok yang sama pula. Berdasarkan pada sifat fisika unsur dan sifat kimia, unsur-unsur juga dapat digolongkan sebagai logam, non logam, dan juga metaloid.
Untuk unsur logam akan memiliki konduktivitas tinggi, sedangkan unsur non logam memiliki sifat non konduktivitas atau berupa gas. Sementara itu, unsur metaloid memiliki konduktivitas di antara nonlogam dan logam.
Perkembangan Sistem Periodik Unsur
Sistem periodik unsur yang digunakan dewasa ini merupakan buah perjalanan yang panjang. Eksperimen terus dilakukan guna menghasilkan tabel periodik yang sesuai. Adapun perkembangan sistem periodik unsur akan dijelaskan pada uraian di bawah ini.
1. Sistem periodik unsur logam-non logam
Awalnya, unsur-unsur yang ada di alam ini hanya dikelompokkan berdasarkan sifat fisik logam dan non logam saja. Unsur dengan sifat mengkilap, berwujud padat pada suhu kamar, dan dapat menghantarkan panas akan dikelompokkan pada golongan unsur-unsur logam.
Sementara itu, kelompok non logam terdiri dari unsur-unsur yang memiliki sifat tidak mengkilap serta rapuh dan sulit dibentuk. Unsur yang berwujud cair, padat, dan gas pada suhu kamar serta kurang baik dalam menghantarkan listrik juga akan dikelompokkan pada golongan non logam.
Namun, pengelompokan ini masih terbilang sederhana. Masih ada banyak sifat dari unsur-unsur tersebut yang dapat dibedakan lagi. Maka dari itu, Triade Dobereiner kemudian melakukan eksperimen pada tahun 1829.
2. Sistem periodik unsur Triade Dobereiner
Dalam eksperimennya, John Wolfgang Dobereiner menyadari bahwa beberapa unsur memiliki kemiripan sifat. Unsur-unsur dengan sifat-sifat yang mirip tersebut kemudian dikelompokkan menjadi satu. Satu kelompok terdiri dari tiga unsur, sehingga kemudian disebut dengan triade.
Pengelompokkan tiga unsur dalam satu triade ini didasarkan pada kenaikan massa atom relatifnya. Massa atom dari unsur yang kedua merupakan hasil rata-rata massa atom relatif antara unsur yang pertama dan juga unsur yang ketiga. Berikut adalah tabel pengelompokkan unsur-unsur menurut Dobereiner.
(Ilustrasi: bisakimia.com)
Sistem triade ini masih memiliki kelemahan dan dinilai kurang efisien karena masih ada beberapa unsur yang tidak masuk ke dalam satu triade. Padahal, kenyataannya sifat yang dimiliki unsur-unsur tersebut hampir sama dengan unsur lain yang ada pada triade tersebut.
3. Sistem periodik unsur Oktaf Newland
Pengelompokan unsur dari Dobereiner ini kemudian disempurnakan oleh A.R. Newlands, ahli kimia Inggris. Pada tahun 1846, Newlands mengemukakan teorinya yang dikenal dengan hukum Oktaf. Dalam teorinya, Newlands menyusun unsur-unsur atas dasar kenaikan massa atom relatifnya.
Unsur yang memiliki selisih satu oktaf akan menunjukkan kemiripan sifat. Untuk pengelompokan unsur berdasarkan hukum oktaf dapat kalian lihat pada tabel berikut.
(Ilustrasi: mfyeni.wordpress.com)
Jika dilihat dari tabel di atas, maka kalian tidak akan menemukan unsur-unsur gas mulia, seperti Ne, He, Kr, Xe, Ar, dan Rn. Sebab, unsur gas mulia ini baru saja ditemukan pada tahun 1984 oleh Ramsay dan Rayleigh. Adapun unsur gas mulia yang pertama kali ditemukan yaitu gas argon.
Hukum oktaf masih memiliki kelemahan karena hanya dapat digunakan untuk unsur-unsur yang ringan saja. Untuk unsur dengan massa atom relatif besar akan terlalu dipaksakan jika tetap dikelompokkan berdasarkan kemiripan sifatnya. Seperti misalnya, unsur Zn yang ternyata memiliki sifat cukup berbeda dengan Mg, Be, dan juga Ca.
4. Sistem periodik unsur Ivanovich Mendeleev
Pada tahun 1869, Dmitri Ivanovich Mendeleev mengemukakan hasil pengamatannya. Menurut Mendeleev, sifat-sifat 63 unsur yang sudah ditemukan tersebut merupakan fungsi periodik dari persamaan sifat dan juga massa atom relatifnya. Itu berarti, jika unsur-unsur disusun berdasarkan kenaikan massa atom relatif, kemiripan unsur tersebut secara periodik akan berulang.
Mendeleev kemudian meletakkan unsur-unsur yang memiliki kemiripan sifat dalam satu golongan yang ditulis dalam lajur vertikal. Sementara itu, lajur horizontal yang disebut dengan periode akan berisi unsur-unsur dengan massa atom relatif yang terus meningkat.
Nah, tabel pengelompokan unsur menurut Mendeleev ini dapat kamu lihat di bawah ini.
Dari tabel di atas, dapat dilihat bahwa unsur-unsur yang saling berdekatan akan memiliki selisih massa atom yang kecil, yaitu sekitar satu atau dua satuan. Pada tabel tersebut juga terlihat bahwa masih ada kotak kosong karena unsur tersebut belum ditemukan, seperti unsur dengan nomor atom 100, 72, 68, dan 42.
Penemuan Mendeleev ini memiliki beberapa kelebihan, salah satunya yaitu dapat meramalkan sifat unsur yang nantinya akan menghuni kotak kosong. Tak hanya itu, tabel Mendeleev ini juga dapat mengoreksi pengukuran massa atom relatif yang salah. Seperti contoh, pada pengukuran massa atom relatif Cr yang harusnya 52,0 bukan 43,3.
Sayangnya, sistem periodik unsur yang ditemukan Mendeleev ini tidak dapat menjelaskan alasan panjang periode yang tidak sama. Valensi unsur-unsur yang lebih dari satu juga sulit diramalkan hanya dari golongannya saja. Selain itu, adanya anomali pada unsur hidrogen juga tidak dapat diketahui penyebabnya.
5. Sistem periodik unsur modern
Sekitar tahun 1914, Henry G Moseley kemudian menyempurnakan tabel periodik Mendeleev. Moseley menemukan bahwa unsur-unsur dalam tabel periodik diurutkan berdasarkan kenaikan nomor atom.
Jika sebelumnya penempatan unsur Ar iodin dan telurium yang tidak sesuai dengan kenaikan nomor atom, ternyata sudah sesuai dengan kenaikan nomor atomnya. Sistem periodik yang disusun atas dasar kenaikan nomor atom dan juga kemiripan sifat ini memiliki bentuk panjang.
Sistem periodik ini terdiri dari 7 periode, 8 golongan utama, dan 8 golongan transisi. Adapun susunan tabel sistem periodik unsur modern memiliki format sebagai berikut:
1. Setiap unsur berada pada satu kotak yang terdiri dari lambang unsur, nomor atom, dan nomor massa. Setiap kotak tersebut diurutkan dari kiri menuju kanan sesuai dengan kenaikan pada nomor atom.
2. Setiap kotak tersebut tersusun hingga membentuk barisan vertikal atau biasa disebut golongan dan barisan horizontal yang biasa disebut periode. Masing-masing periode akan diberi nomor dari 1 sampai 7, sedangkan masing-masing golongan akan diberi nomor dari 1 sampai 8 menggunakan huruf A maupun B.
Namun, dalam sistem IUPAC yang baru, masing-masing golongan akan diberi nomor dari 1 sampai 18 tanpa menggunakan huruf A maupun B. Setiap unsur yang terdapat pada golongan yang sama dalam sistem periodik akan terdapat kemiripan sifat.
3. Setiap unsur dari golongan 1A sampai 8A (golongan 1-2, 13-18) disebut unsur golongan utama. Sedangkan setiap unsur dari golongan 1B sampai 8B (golongan 3-12) disebut unsur logam transisi. Dua baris unsur terbawah yaitu lantanida serta aktinida, dinamakan unsur logam transisi dalam.
(Ilustrasi: gurupendidikan.co.id)
Sifat Unsur pada Sistem Periodik Unsur
Berdasarkan sifatnya, unsur dapat diklasifikasikan menjadi unsur nonlogam, logam, dan metaloid. Unsur logam bersifat penghantar listrik dan panas yang baik, titik lebur relatif tinggi, bisa ditempa, biasanya melepas elektron menuju unsur nonlogam.
Unsur nonlogam bersifat konduktor listrik dan panas yang buruk, tidak bisa ditempa, umumnya berwujud gas pada suhu kamar. Biasanya, unsur non logam akan menyerap elektron yang berasal dari unsur logam. Sementara itu, unsur metaloid bersifat sama hal nya dengan unsur logam serta nonlogam.
Sifat logam akan berkurang dari bawah menuju atas dan dari kiri menuju kanan sistem periodik unsur, selain hidrogen. Unsur metaloid terletak pada “tangga” yang menjadi pembatas antara unsur logam dan nonlogam.
Sifat Keperiodikan Suatu Unsur
Sifat keperiodikan suatu unsur yang dilihat melalui tabel periodik terbaru ini terdiri atas jari-jari atom, energi ionisasi, jari-jari ion, afinitas elektron, dan keelektronegatifan. Untuk penjelasan masing-masing sifat dapat kalian lihat pada ulasan di bawah ini.
1. Jari-Jari Atom
Jari-jari atom merupakan setengah jarak antara dua atom logam dan dua inti logam dalam sebuah molekul diatomik yang memiliki letak sejajar. Dalam satu golongan, jari-jari atom relatif akan semakin besar jika dilihat dari atas ke bawah. Hal ini sebagaimana terjadinya pertambahan kulit elektron.
Sementara itu, jari-jari atom akan semakin mengecil jika dilihat dari kiri ke kanan. Hal ini disebabkan lantaran muatan ini efektif mengalami penambahan.
(Ilustrasi: dosenpintar.com)
2. Energi Ionisasi
Umumnya, suatu atom maupun ion akan melepaskan sebuah elektron dalam fase gasnya. Untuk melepaskan sebuah elektron, atom atau ion tersebut membutuhkan suatu energi yang disebut dengan energi ionisasi.
Energi ionisasi suatu atom dalam satu golongan cenderung akan semakin kecil jika dilihat dari atas ke bawah. Mengapa? Sebab, jarak elektron dengan inti atom terluarnya terus bertambah, sehingga tarikan antara elektron terluar dengan inti atom juga berkurang.
Sementara itu, atom-atom dalam satu periode akan mengalami peningkatan energi ionisasi dari kiri ke kanan. Hal ini disebabkan lantaran muatan ini efektif terus mengalami penambahan. Akibatnya, tarikan antara inti atom dan juga elektron terluar semakin bertambah.
(Ilustrasi: utakatik.com)
3. Jari-Jari Ion
Jari-jari ion ini tidaklah sama dengan jari-jari atom. Jari-jari ion ini merupakan besarnya jari-jari anion atau kation. Perhitungannya sendiri didasarkan pada jarak antara dua inti anion atau kation yang ada pada kristal ionik.
Ion bermuatan positif atau kation ini terbentuk dari pelepasan elektron yang berasal dari kulit terluar atom yang bermuatan netral. Dengan begitu, tarikan antara elektron dengan inti akan lebih kuat dan tolakan antar elektron akan berkurang. Akibatnya, jari-jari kation akan lebih kecil dibandingkan dengan jari-jari atom netralnya.
Untuk ion dengan muatan negatif (anion), akan terbentuk akibat penangkapan elektron yang terjadi pada atom netral. Akibatnya, tolakan antar masing-masing elektron akan bertambah, sehingga jari-jari anion akan lebih besar dibandingkan dengan jari-jari atom netralnya.
Jari-jari ion atom-atom satu golongan yang memiliki muatan sama jika dilihat dari atas ke bawah cenderung akan semakin besar. Hal ini sebagaimana terjadinya penambahan kulit elektron.
Pada deretan ion isoelektronik yang masuk dalam satu periode, jari-jari ionnya akan semakin kecil seiring dengan semakin besarnya muatan pada kation. Sementara itu, jika muatan anionnya semakin besar, jari-jari ionnya pun akan semakin besar pula.
Ion isoelektronik yang dimaksud di atas yaitu spesi spesi yang memiliki konfigurasi elektron dan jumlah elektron yang sama. Seperti misalnya, yang sama-sama memiliki 10 elektron.
(Ilustrasi: Silberberg, Marti: 2009)
4. Afinitas Elektron
Saat sebuah ion atau atom menerima elektron pada fase gas, maka akan terjadi perubahan energi. Nah, kuantitas perubahan energi ini disebut dengan afinitas elektron. Jika energi tersebut diserap, kuantitas perubahan energinya akan bertanda positif.
Sementara itu, jika energi tersebut dilepaskan, afinitas elektronnya akan bertanda negatif. Semakin negatif kuantitas perubahan energi suatu atom atau ion, itu berarti kecenderungan ion atau atom tersebut dalam menerima elektron akan semakin besar.
Afinitas elektron dari atom atau ion dalam satu golongan cenderung akan semakin mengecil jika dilihat dari atas ke bawah. Namun, hal ini tetap ada beberapa pengecualian. Untuk atom atau ion satu periode dari kiri ke kanan (hanya sampai golongan VII A saja), maka afinitas elektronnya relatif akan terus meningkat.
(Ilustrasi: perbedaan.budisma.net)
5. Elektronegativitas
Suatu atom dalam sebuah molekul yang berikatan cenderung akan menarik elektron. Elektronegativitas inilah yang menyatakan ukuran kemampuan suatu atom dalam menarik elektron. Semakin mudah suatu atom untuk menarik elektron, semakin besar pula elektronegativitasnya, begitu juga sebaliknya.
Dalam satu periode jika dilihat dari kiri ke kanan, elektronegativitas suatu atom akan cenderung semakin besar. Sementara itu, untuk satu atom dalam satu golongan dari atas ke bawah akan memiliki elektronegativitas yang cenderung akan semakin kecil.
(Ilustrasi: Petrucci, Ralph H. et al, 2011)
Bagaimana? Apakah kalian sudah mulai memahami apa itu sistem periodik unsur dan sifat-sifat keperiodikan yang mendasarinya? Mungkin dari penjelasan-penjelasan di atas, kalian akan bertanya-tanya.
FAQ
Demikian pembahasan mengenai sistem periodik unsur dan sifat keperiodikan suatu unsur. Kalian dapat melihat video pada video dibawah ini:
Kesimpulannya, sistem periodik unsur digunakan untuk mengelompokkan suatu unsur berdasarkan kemiripan sifat dan mengurutkannya berdasarkan nomor atom. Unsur-unsur dalam tabel periodik memiliki sifat keperiodikan. Sifat-sifat tersebut di antaranya yaitu jari-jari atom, energi ionisasi, jari-jari ion, afinitas elektron, dan keelektronegatifan.