Download Laporan Praktikum Destilasi Sederhana dan landasan teori mengenai destilasi sederhana lengkap dengan pembahasan dalam format PDF. Laporan Praktikum ini merupakan kelanjutan dari Laporan Praktikum kimia organik yang pernah admin bahas minggu lalu, laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
BAB I PENDAHULUAN
Tujuan :
- Memahami prinsip destilasi sederhana
- Mengetahui cara melakukan destilasi sederhana
Latar Belakang
Pemisahan campuran dapat dlakukan dengan berbagai cara bergantung pada sifat pencamurannya. Zat cair dapat dipidahkan dan dimurnikan dengan cara destilasi, seperti campuran alkohol dan air. Senyawa yang terdapat dalam campuran akan menguap saat mencapai titik didih masing-masing. Penurunan suhu ruang sangat mempengaruhi proses destilasi, karena jika suhu ruang terlalu dingin, proses destilasi akan berlangsung lama. Berbandng terbalik dengan keadaan saat naiknya suhu ruang, maka proses destilasi akan berlangsung cepat.
Destilasia dalah sebuah aplikasi yang mengikuti prinsip jika suatu zat dalam larutan tidak sama-sama menguap, maka uapa larutan akan mempunyai komponen yang berbeda dengan larutan alinya. Jika salah satu zat menguap dan yang lain tidak, pemisahan dapat terjadi sempurna. Tetapi jika kedua zat menguap tetapi tidak sama, maka pemisahnya hanya akan terjadi sebagian, akan tetapi destilat atau produk akan menjadi kaya pada suatu komponen dari pada larutan aslinya. Terdapat beberapa teknik pemisahan melalui destilasi, salah satunya adalah destlasi sederhana. Oleh karena itu dilakukan praktikum ini untuk lebih mengetahui prinsp dan cara kerja destilasi sederhana.
BAB II KAJIAN PUSTAKA
A. Pengetian Destilasi
Distilasi atau penyulingan adalah suatu metode pemisahan bahan kimia berdasarkan perbedaan kecepatan atau kemudahan menguap (volatilitas) bahan atau didefinisikan juga teknik pemisahan kimia yang berdasarkan perbedaan tiitk didih. Dalam penyulingan, campuran zat dididihkan sehingga menguap, dan uap ini kemudian didinginkan kembali kedalam bantuk cairan. Zat yang memliki titik didih lebih rendah akan menguap terlebih dahulu. Metode ini termasuk sebagai unit operasi kimia jenis perpindahan massa. Penerapan proses ini didasarkan pada teori bahwa pada suatu larutan, masing-masing komponen akan menguap pada titik didihnya. Model ideal distilasi didasarkan pada hukum Raoult dan hukum Dalton.
Menurut Yazid (2005), destilasi adalah metode pemisahan zat-zat cair dari campurannya berdasarkan perbedaan titik didih. Pada proses destilasi sederhana, suatu campuran bisa dipisahkan bila zat-zat penyusunnya mempunyai perbedaan titik didih cukup tinggi. Proses destilasi terdiri atas dua bagian, yaitu bagian pertama terdiri dari uap yang terembunkan disebut destilat, dan bagian kedua adalah cairan yang tertinggal disebut residu, yang susunannya lebih banyak komponen yang sukar menguap.
Destilasi juga merupakan suatu perubahan cairan menjadi uap dan uap tersebut didingnkan kembali menjadi cairan. Unit operasi destilasi merupakan metode yang digunakan untuk memisahkan komponen-komponennya yang terdapat dalam salah satu larutan atau campuran dan bergatung pada distribusi komponen-komponen tersebut antara fasa uap dan fasa air. Syarat utama dalam operasi pemisahan komponen-komponen dengan cara destilasi adalah komposisi uap harus berbeda dengan komposisi cairan sehingga terjadi kesetimbangan larutan-larutan, dengan komponen-komponennya cukup dapat menguap.
B. Sejarah Destilasi
Destilasi pertama kali ditemukan oleh kimiawan Yunani sekitar abad pertama masehi yang akhirnya perkembangannya dipicu terutama oleh tingginya permintaan sprotus Hypathia dari Alexandria dipercaya telah menemukan rangkaian alat untuk detilasi da Zosimus dari Alexandria-lah yang telah berhasil menggambarkan secara akurat tentang proses destilasi pada sekitar abd ke-4. Bentuk modern destilasi pertama kali ditemukan oleh ahli-ahli kimia Islam pada masa kekhalifahan Abbasiah, terutama oleh Al-Raazi pada pemisahan alkohol menjadi senyawa yang relative murni melalui alat alembik, bahkan desain ini menjadi semacam inspirasi yang memungkinkan rancangan destilasi skala mikro, The Hickman Stllhead dapat terwujud. Tulisan oleh Jabir Ibnu Hayyan (721-815) yang lebih dikenal dengan Ibnu Jabir menyebutkan tentang uap anggur yang dapat terbakar. Ia juga telah menemukan banyak peralatan dan proses kimia yang bahkan masih banyak dipakai sampai saat kini. Kemudian teknik penyulingan diuraikan dengan jelas oleh Al-Kindi (801 – 873).Salah satu penerapan terpenting dari metode distilasi adalah pemisahan minyak mentah menjadi bagianbagian untuk penggunaan khusus seperti untuk transportasi, pembangkit listrik, pemanas, dan lain-lain. Udara didistilasi menjadi komponen-komponen seperti oksigen untuk penggunaan medis dan helium pengisi balon Distilasi telah digunakan sejak lama untuk pemekatan alkohol dengan penerapan panas terhadap larutan hasil fermentasi untuk menhasilkan minuman suling B.
C. Macam-Macam Destilasi
Secara umum destilasi terbagi atas 4 jenis, yaitu destilasi sederhana, destilasi fraksionasi, destilasi uap, dan destilasi vakum.
a. Destilasi sederhana
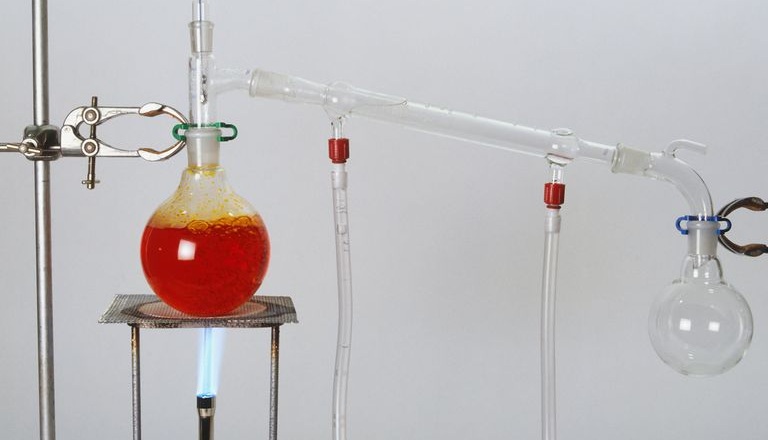
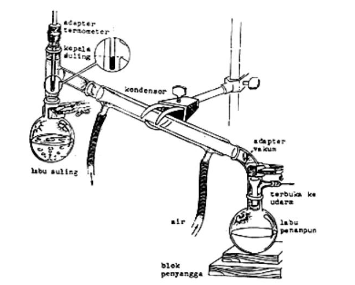
Destilasi sederhana adalah salah satu cara pemurnian zat cai yang tercemar oleh zat padat/ zat cair lain dengan perbedaan titik didih cukup besar. Sehingga zat pencemar atau pengotor akan tertinggal sebagai residu. Destilasi ini digunakan untuk memisahkan campuran cair-cair. Alat yang digunakan dalam proses destilasi ini antara lain, labu destilasi, penangas, termometer, pendingin/ kondensor leibig, konektor/ klem, statif, adaptor, penampung, pembakar, kaki tiga, dan kasa.
Pada distilasi sederhana, dasar pemisahannya adalah perbedaan titik didih yang jauh atau dengan salah satu komponen bersifat volatil. Jika campuran dipanaskan maka komponen yang titik didihnya lebih rendah akan menguap lebih dulu. Selain perbedaan titik didih, juga perbedaan kevolatilan,yaitu kecenderungan sebuah substansi untuk menjadi gas. Distilasi ini dilakukan pada tekanan atmosfer. Aplikasi distilasi sederhana digunakan untuk memisahkan campuran air dan alkohol.
b. Destilasi fraksionasi (bertingkat)
Fungsi distilasi fraksionasi adalah memisahkan komponen-komponen cair, dua atau lebih, dari suatu larutan berdasarkan perbedaan titik didihnya. Distilasi ini juga dapat digunakan untuk campuran dengan perbedaan titik didih kurang dari 20 °C dan bekerja pada tekanan atmosfer atau dengan tekanan rendah. Aplikasi dari distilasi jenis ini digunakan pada industri minyak mentah,untuk memisahkan komponen- komponen dalam minyak mentah.
Perbedaan distilasi fraksionasi dan distilasi sederhana adalah adanya kolom fraksionasi. Dikolom ini terjadi pemanasan secara bertahap dengan suhu yang berbeda-beda pada setiap platnya. Pemanasan yang berbeda-beda ini bertujuan untuk pemurnian distilat yang lebih dari plat-plat di bawahnya. Semakin ke atas, semakin tidak volatil cairannya.
c. Destilasi uap
Distilasi uap digunakan pada campuran senyawa-senyawa yang memiliki titik didih mencapai 200°C atau lebih. Distilasi uap dapat menguapkan senyawa-senyawaini dengan suhu mendekati 100°C dalam tekanan atmosfer dengan menggunakan uap atau air mendidih. Sifat yang fundamental dari distilasi uap adalah dapat mendistilasicampuran senyawa di bawah titik didih dari masing-masing senyawa campurannya. Selain itu distilasi uap dapat digunakan untuk campuran yang tidak larut dalam air di semua temperatur, tapi dapat didistilasi dengan air.
d. Destilasi vakum
Distilasi vakum biasanya digunakan jika senyawa yang ingin didistilasi tidak stabil, dengan pengertian dapat terdekomposisi sebelum atau mendekati titik didihnya atau campuran yang memiliki titik didih di atas 150 °C. Metode distilasi ini tidak dapat digunakan pada pelarut dengan titik didih yang rendah jika kondensornya menggunakan air dingin, karena komponen yang menguap tidak dapat dikondensasioleh air. Untuk mengurangi tekanan digunakan pompa vakum atau aspirator. Aspirator berfungsi sebagai penurun tekanan pada sistem distilasi ini.
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum destilasi sederhana ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum destilasi sederhana ini, sebagai berikut:
Alat
- satu set peralatan destilasi
- labu erlenmeyer
- corong
- pemanas yang sesuai
- termometer
- statif
- clamp
- mantel
- penjepit
Bahan
- aquades
- metanol
- batu didih
- vaseline
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum destilasi sederhana :
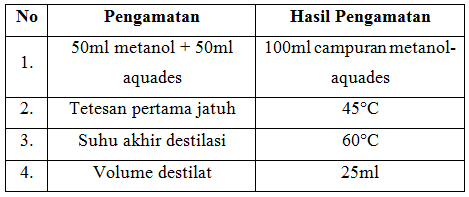
- Masukkan 40ml metanol ke dalam labu alas bulat
- Tambahkan 40ml aquades ke dalam labu alas bulat
- Masukkan batu didih ke dalam labu alas bulat
- Susun perangkat destilasi sederhana
- Lakukan pemanasan dan catat suhu saat tetesan pertama mulai jatuh
- Kontrol suhu agar tidak mendekati titik didih metanol
- Hentikan pemanasan jika metanol berhenti mendidih
- Ukur volume dan hitung randemen metanol
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
Perhitungan % randemen

B. Pembahasan
Adapun pembahasan dalam laporan praktikum destilasi sederhana ini adalah sebagai berikut :
Pada praktikum kimia organik kali ini dilakukan percobaan mengeani destilasi sederhana. Praktikum kali ini bertujuan untuk mengetahui prinsip serta langkah-langkah dalam men-destilasi suatu zat. Secara umum destilasi merupakan pemisahan suatu komponen pada suatu zat cair berdasarkan titik didihnya. Campuran zat cair yangakan dipisahkan dididihkan dan uap yang terbentuk diembunkan di dalam kondenser. Prinsip dasar dari destilasi adalah perbedaan titik idih masing-masing zat dalam larutan, sehingga apabila dipanaskan pada suhu tertentu maka zat yang memiliki titik didih lebih rendah akan menguap terlebih dahulu. Zat yang menguap terlebih dahulu inilah yang disebut destilat.
Zat yang kami gunakan pada praktikum destilasi sederhana ini adalah metanol dan air. Titik didih metanol adalah 64,7°C, sedangkan titik didih air adalah 100°C. Titik didih air lebih tinggi jika dibandingkan dengan metanol, hal ini karena ikatan hidrogen pada molekul air dapat membentuk lebih banyak dibandingkan metanol. Molekul air dapat membentuk tiga ikatan hidrogen dengan molekul air lainnya. Dimana pada satu molekul air terdapat dia atom H yang dapat mengikat dua atom O dari molekul air yang lain dan terdapat satu atom O yang dapat mengikat satu atom H dari molekul air lainnya. Semakin kuatnya ikatan hidrogen yang terbentuk menyebabkan kenaikan titik didih. Ini disebabkan ikatan hidrogen yang sangat kuat, membutuhkan energi yang kuat pula untuk bisa memutuskan ikatan hidrogen. Sehingga untuk bisa membuat air mendidih dibutuhkan suhu yang lebih besar jika dibandingkan dengan metanol.
Metode destilasi yang digunakan saat ini adalah destilasi sederhana. Dan diharapkan metanol sebagai destilat jika dilihat dari titik didinya. Penggunaan batu didih pada proses destilasi bertujuan untuk mempercepat proses pendidihan sampel dengan menahan tekanan atau menekan gelembung panas pada sampel serta menyebabkan panas yang ada menyebar keseluruh bagian sampel. Tetesan pertama dari destilat berada pada suhu 45°C, yang diharapkan pada percobaa ini tetesan pertama akan jatuh pada suhu 64°C keatas, namun karena destilat sudah memberikan tetesan dapat diindikasikan bahwa metanol yang digunakan tidak benar-benr murni. Pada akhir dari proses destilasi menunjukkan pada suhu 60°C. Volume destilat yang didapatkan adalah 25ml, dengan persen randemen sebesar 25%.
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum destilasi sederhana dapat disimpulkan bahwa :
- Destilasi sederhana adalah salah satu metode yang digunakan untuk pemurnian dan pemisahan suatu larutan yang berdasarkan pada perbedaan titik didihyang relative jauh.
- Prinsip dasar dari destilasi adalah perbedaan titik idih masing-masing zat dalam larutan, sehingga apabila dipanaskan pada suhu tertentu maka zat yang memiliki titik didih lebih rendah akan menguap terlebih dahulu.
- Hasil dari destilasi metanol adalah sebanyak 25ml dengan %randemen sebesar 25%.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Yazid, Estien. 2005. Kimia Fisika Untuk Paramedis. Yogyakarta: CV Andi Offset.