Download Laporan Praktikum Sintesis Metil Salisilat dan landasan teori mengenai metil salisilat lengkap dengan pembahasan dalam format PDF. Laporan Praktikum ini merupakan kelanjutan dari Laporan Praktikum kimia organik yang pernah admin bahas minggu lalu, laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
BAB I PENDAHULUAN
Tujuan :
- Memahami cara mensintesis metil salisilat
- Memahami mekanisme reaksi dari metil salisilat
Latar Belakang
Istilah sintesis mempunyai arti yang luas dan dapat digunakan pada fisika, kimia, ideologi serta fenomenologi. Sintesis juga dapat diartikan sebagai hasil akhir dari percobaan untuk menggabungkan dua senyawa kimia atau lebih. Selain itu sintesis dapat pula diartikan sebagai proses pembentukan sebuah molekul tertentu dari prekursor kimia.
Sebagai negara berkembang, Indonesia banyak melakukan pengembangan disegala macam bidang, salah satunya adalah bidang industri termasuk industri kimia. Seiring perkembangan industri kimia Indonesia, salah satu kebutuhan yang terus bertambah adalah kebutuhan akan metil salisilat. Namun sayangnya Indonesia masih mengimpor akan kebutuhan tersebut.
Metil salisilat dapat disintesis melalui esterifikasi asam salisilat. Reaksi esterifikasi adalah reaksi pembentukan senyawa ester dari asam karboksilat dan alkohol dengan katalis asam. Senyawa ester yang dihasilkan akan memiliki aroma tertentu dan bersifat khas. Dalam ilmu kimia dan bidang farmasi reaksi esterifikasi ini cukup penting mengingat reaksi tersebut merupakan dasar sintesis banyak senyawa kimia yang dapat berkhasiat sebagai obat. Salah atu penggunaannya adalah sintesis metil salisilat dari asam salisilat dengan metanol absolut. Dari pernyataan yang telah dipaparkan, maka penting dilakukan praktikum ini.
BAB II KAJIAN PUSTAKA
A. Asam Salisilat
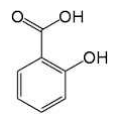
Asam salisilat, dikenal juga dengan asam 2-hidroksi benzoat atau asam- ortohidrobenzoat yang memiliki struktur kimia C7H6O3. Asam salisilat telah digunakan sebagai bahan terapi topikal lebih dari 100 tahun yang lalu. Dalam bidang dermatologi, asam salisilat telah lama dikenal dengan khasiat utamanya sebagai bahan keratolitik. Hingga saat ini asam salisilat masih digunakan dalam terapi veruka, kalus, psoriasis, dermatitis seboroik pada kulit kepala, dan iktiosis. Penggunaannya semakin berkembang sebagai bahan peeling dalam terapi penuaan kulit, melasma, hiperpegmentasi pasca inflamasi, dan akne (Lee dan Kim, 2003). Struktur asam salisilat adalah sebagai berikut :
Asam salisilat merupakan obat analgesik non narkotik yang sering digunakan dalam masyarakat. Asam salisilat mempunyai aktivitas analgesik, antipiretik dan antirematik tetapi tidak dapat digunakan secara oral karena terlalu toksik, sehingga yang banyak digunakan sebagai analgesik adalah senyawa turunannya seperti asam asetilsalisilat. Asam asetil salisilat yang lebih dikenal dengan aspirin atau asetosal digunakan sebagai analgesik, antipiretik dan antirematik. Pemberian asam asetilsalisilat dalam dosis rendah digunakan untuk mencegah serangan jantung dan pengobatan trombosis karena memiliki efek antiplatelet (Purwanto dan Susilowati, 2000).
B. Metil Salisilat
Salah satu turunan dari asam salisilat adalah metil salisilat. Metil salisilat adalah cairan kuning kemerahan dengan bau wintergreen. Tidak larut dalam air tetapi larut dalam alkohol dan eter. Metil salisilat sering digunakan sebagai bahan farmasi, penyedap rasa pada makanan, minuman, gula-gula, pasta gigi, antiseptik,dan kosmetik serta parfum. Metil salisilat telah digunakan untuk pengobatan sakir syaraf, sakit pinggang, radang selaput dada, dan rematik, juga sering digunakan sebagai obat gosok dan balsem (Supardani, dkk., 2006).
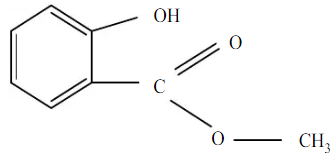
Metil Salisilat atau 2-hydroxy benzoid acid methyl ester dengan rumus kimia C8H8O3 di alam bahan ini banyak terdapat dalam daun tanaman gaultheria procumbens, batang tanaman betula lenta.l, sweet birch dan berupa glucoside pada bermacam tanaman lainya. Sedangkan secara sintesis, metil salisilat dapat dibuat dengan reaksi esterifikasi antara metanol dengan asam salisilat dengan bantuan katalis. Struktur metil salisilat adalah sebagai berikut :
Pada penetapan kadar asam salisilat, alkohol digunakan sebagai pelarut karena asam salisilat hampir tidak larut dalam air. Alkohol bersifat asam lemah dan jumlah asam dalam alkohol bervariasi kerena terbukanya alkohol karena oksidasi. Oleh karena itu alkohol harus dinetralkan terhadap indikator yang digunakan supaya tidak bereaksi dengan natrium hidroksida ketika dititrasi berlangsung. Sebaiknya digunkan natrium hidroksida ketika titrasi berlangsung. Sebaiknya natrium hidroksida bebas karbonat untuk menghindari kesalahan pada titik terakhir dengan terlepasnya karbon dioksida (Supardani, 2006).
C. Beberapa Macam Proses Produksi Metil Salisilat
a. Ekstraksi
Metil salisilat dapat diambil dari tanaman wintergreen dan sweet birch dengan ekstraksi karena tanaman tersebut banyak mengandung glucoside. Bahan yang telah disortasi atau batang dari tanaman sweet birch yang telah direduksi ukurannya direndam dalam air suling di dalam alat penyuling pada suhu sekitar 49ºC (120ºF) selama semalam, kemudian didistilasi secara batch selama 5 atau 6 jam. Distilat dipisahkan menjadi lapisan minyak (atas) dan air (bawah). Lapisan air dikembalikan ke alat penyuling. Operasi distilasi dihentikan apabila air sudah tidak menggandung suspensi minyak. Proses ekstraksi bahan alam ini harus memenuhi range spesific gravity sebesar 1,176 – 1,182 dan titik didih 219 – 284ºC untuk mendapatkan yield sebesar 99%. Yield minyak yang banyak hanya dapat diperoleh dari bahan yang segar, sehingga masa penyimpanan bahan maksimal hanya 2 minggu dan untuk proses batch membutuhkan waktu sekitar 30 jam (Guenther, 1949).
b. Esterifikasi dengan katalis asam sulfat
Asam salisilat, alkohol berlebih, dan katalis ditambahkan ke dalam reaktor. Panas ditambahkan ke reaktor sampai mencapai suhu reaksi. Ketika konsentrasi asam telah berkurang sesuai dengan tingkatan yang dinginkan (konversi), produk dipisahkan. Karena esterifikasi antara alkohol dan dan asam organik merupakan reaksi kesetimbangan dapat balik, maka untuk mencapai konversi yang tinggi perlu perlu pemisahan salah satu produk yang terbentuk (ester dan air). Metil salisilat merupakan ester non volatile, di mana alkoholnya secara nyata tidak larut dalam air, sehingga metode distilasi dapat digunakan untuk memindahkan air dari reaksi (Kirk and Othmer, 1979).
Adapun reaksi yang terjadi dalam pembentukan metil salisilat dari metanol dan asam salisilat adalah sebagai berikut:
C7H6O3 + CH3OH ↔ C8H8O3 + H2O (Chandavasu, 1997).
c. Esterifikasi dengan membrane integrated reactor
Pemisahan air selain menggunakan distilasi, dapat juga menggunakan membrane reactor, dimana air yang dihasilkan dipindahkan melalui permselective membrane dari zona reaksi, proses reaksi akan terus berlangsung sehingga dapat tercapai konversi yang tinggi (Chandavasu, 1997).
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum sintesis metil salisilat ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum sintesis metil salisilat ini, sebagai berikut:
Alat
- gelas ukur
- labu alas bulat
- corong
- seperangkat alat refluk
- corong pisah
- erlenmeyer
Bahan
- asam salisilat 28gr
- metanol absolut 120ml
- asam sulfat pekat 30ml
- natrium bikarbonat 5% 50ml
- magnesium sulfat anhidrat 8gr
- batu didih
- aquades
- indikator pH universal
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum sintesis metil salisilat :
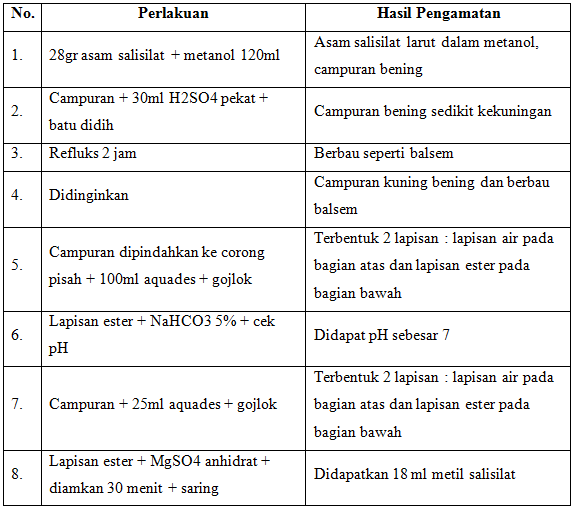
- Masukkan 28 grasam salisilat ke dalam labu alas bulat
- Tambahkan 120ml metanol absolut, kocok hingga asam salisilat melarut
- Tambahkan H2SO4 pekat (lakukan dilemari asam), masukkan batu didih
- Pasang labu pada perangkat refluks. Lakukan refluks selama 2 jam
- Dinginkan labu alas bulat dengan air mengalir. Pindahkan campuran ke dalam corong pisah
- Tambahkan 100ml aquades dingin ke dalam corong pisah
- Kocok perlahan hingga terbentuk 2 lapisan
- Ambil lapisan bawah (ester) yang terbentuk, kemudian cuci lapisan ester dengan NaHCO3 5% di dalam corong pisah
- Gojlok hingga homogen. Cek pH pastikan pH 7
- Tambahkan 25ml aquades, gojlok agak kuat hingga terbentuk 2 lapisan
- Ambil lapisan bawah. Tambahkan 8gr MgSO4 anhidrat, diamkan selama 30 menit
- Saring menggunakan vakum. Ukur volume yang diperoleh
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
B. Perhitungan
Berat teori

Berat praktek

% randemen

C. Pembahasan
Adapun pembahasan dalam laporan praktikum sintesis metil salisilat ini adalah sebagai berikut :
Pada praktikum kimia organik kali ini kami melakukan perrcobaan mengenai sintesis metil salisilat. Percobaan ini dilakukan dengan tujuan agar dapat mengetahui cara mensintesis metil salisilat serta memahami mekanisme reaksi metil salisilat. Metil Salisilat termasuk senyawa ester yang dapat dibuat secara sintesis dengan jalan mereaksikan suatu senyawa asam karboksilat dengan alkohol dalam suasana asam. Proses esterifikasi tersebut dikenal sebagai esterifikasi fisenar. Dari proses tersebut diperoleh hasil sampingan yaitu H2O untuk mengetahui dari mana H2O tersebut digunakan metode yang dikenal labeling isotop, ternyata air yang terbentuk bukan berasal dari asam tetapi dari gugus OH milik asam.
Langkah awal dari percobaan adalah mencampurnak asam salisilat dengan metanol absolut. Penggunaan metanol absolut dipilih karena metanol absolut memiliki kandungan air yang sangat sendikt, sehingga dapat menekan hasil samping air yang akan terbentuk jika dibandingkan dengan metanol biasa. Lalu menambahkan katalis (untuk mempercepat proses esterifikasi) berupa asam sulfat pekat. Penggunaan asam sulfat yang pekat karena yang pekat memiliki energi aktivasi yang lebih tinggi dibanding dengan yang encer. Hal ini dikarenakan untuk dapat mengkatalisis suatu reaksi, maka katalisator yang digunakan harus mampu menurunkan energi aktivasi reaktan dengan cara mempengaruhinya melalui energi aktifasi miliknya sendiri. Oleh karena itu, diupayakan atau disyaratkan agar energi aktifasi katalisator lebih tinggi dari energi aktifasi reaktan. Kami juga memasukkan batu didih, fungsi dari memasukkan batu didih adalah untuk meratakan panas sehingga panas menjadi homogen pada seluruh bagian larutan, serta untuk mempercepat proses pendidihan dengan menahan tekanan atau menekan gelembung panas pada sampel. Kemudian campuran kami refluks selama 2 jam.
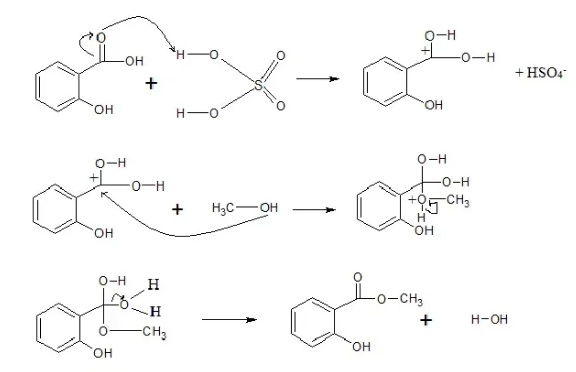
Indikator yang menjadi acuan terbentuknya metil salisilat adalah mulai tercium bau balsem dari campuran yang di refluks. Kemudian campuran dipindahkan ke corong pisah dan ditambahkan dengan aquades lalu digojlok. Terdapat dua lapisan yang terbentuk yakni lapisan air pada bagian atas dan lapisan ester pada bagian bawah. Lapisan ester kemudian ditambahkan NaHCO3 5% dan di cek pH menggunakan indikator pH universal dan didapatkan pH sebesar 7. Kemudian ditambahkan aquades untuk mendapatkan metil salisilat yang benar-banar murni dan digojlok. Penambahan NaHCO3 dimaksud untuk menarik zat pengotor, serta menetralkan kelebihan asam NaHCO3 tersebut akan mengikat ion hidrogendari katalis sehingga terjadi deprotonasi dan eliminasi air (natrium karbonat menarik air) yang dibuktikan dengan terbentuknya dua lapis fasa. Kemudia lapisan ester diambil dan ditambahkan MgSO4 anhidrat yang bertujuan untuk mengikat sisa air yang masih terdapat pada metil salisilat. Kemudian campuran disaring menggunakan vakum dan diperoleh metil salisilat sebesar 18 ml dengan % randemen sebesar 69,25%. Mekanisme reaksi yang terjadi adalah sebagai berikut :
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum sintesis metil salisilat dapat disimpulkan bahwa :
- Metil salisilat dapat disintesis dari asam salisilat dan metanol dengan katalis asam sulfat, proses ini dikenal sebagai esterifikasi sinefar.
- Volume metil salisilat yang didapatkan adalah 18 ml dengan % randemen sebesar 69,25%.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Chandavasu, C. 1997. Pervaporation-assied Esterification of Salicylic acid. Newark, New Jersey: New Jersey Institute of Tecnology.
- Guenther, E. 1949. The Essential Oils, Third ed, 461, D. Van Nostrand. New York: Company Inc.
- Kirk, R.E. and Othmer, D.F. 1979. Encyclopedia of Chemical Technology, 3rd ed., vol. 15-20. New York: The Inter Science Encyclopedia, Inc.
- Lee, K.W., Kim, Y.J., and Lee, C.Y.,2003, Cocoa Has more Phenolik Phytochemical and A higher Antioxidant Capacity than Teas and Red Wine,J.Agric. Food Chem., 51( 52 ),729 – 7295.
- Purwanto, B.T. dan Susilowati, R. 2000. Hubungan Struktur, Sifat Kimia Fisika dan Aktivitas Biologis Obat, In: Siswandono dan Soekardjo, B. (Eds.), Kimia Medisinal 1, ed. 2. Airlangga University Press, Surabaya, 161-163, 283, 291-292.
- Supardani dkk. 2006. Perancangan Pabrik Asam Salisilat dari Phenol.Jurusan Teknik Kimia FTI Institut Teknologi Nasional:Bandung.
