Download Laporan Praktikum Alkohol dan Fenol dan landasan teori mengenai alkohol dan fenol lengkap dengan pembahasan dalam format PDF. Laporan Praktikum ini merupakan kelanjutan dari Laporan Praktikum kimia organik yang pernah admin bahas minggu lalu, laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
BAB I PENDAHULUAN
Tujuan :
- Mengetahui kelarutan alkohol dan fenol dalam air dan n-Heksana.
- Membedakan alkohol primer, sekunder, dan tersier.
- mengetahui reaksi alkohol dan fenol dengan larutan Na2CO3, NaHCO3, dan FeCl3.
- Mengetahui tingkat keasaman alkohol dan fenol.
Latar Belakang
Dalam kehidupan sehari-hari istilah alkohol sering dikaitkan dengan minuman keras. Bahan aktif dalam minuman keras atau minuman beralkohol adalah etanol atau etil alkohol. Berbeda dengan alkohol yang sudah familiar dimasyarakat awal, fenol justru jarang disebut di kalangan masyarakat. Padahal fenol juga termasuk golongan alkohol.
Istilah dalam kimia organik alkohol merupakan nama satuan golongan senyawa organik yang tersusun dari unsur-unsur C, H dan O dengan struktur yang khas. Bila ditinjau dari kemanfaatannya dalam sintesis senyawa organik, alkohol mempunyai peranan penting. Hal ini karena alkohol dapat dibuat menjadi berbagai senyawa organik yang termasuk golongan lain, misalnya alkil halida, aldehida, keton dan asam karboksilat. Disamping sebagai bahan dasar dalam sintesis, alkohol seringkali digunakan sebagai pelarut untuk melangsungkan sejumlah reaksi organik, misalnya metanol digunakan sebagai bahan anti pembekuan, etanol digunakan sebagai sumber panas karena mempunyai nyala yang jernih dan panas, dan lauril alkohol digunakan dalam pembuatan deterjen. Alkohol juga dapat disintesis dari bahan pangan yang memiliki kandungan karbohidrat yang tinggi dengan proses hidrolisis dan fermentasi.
Selain berbentuk alifatik, alkohol juga berbentuk aromatik dalam artian rantai melingkar yakni fenol. Selain dari perbedaan bentuk terdapat perbedaan antara alkohol dan fenol dari kelarutan, keasaman hingga tergolong kedalam alkosi kuat atau lemah. Untuk mengetahui hal tersebat, maka dilakukan praktikum kimia organik mengenai alkohol dan fenol.
BAB II KAJIAN PUSTAKA
A. Alkohol
Istilah alkohol sendiri pada awalnya berasal dari bahasa Arab “Al Kuhl” (bubuk halus antimon atau substansi murni lain) yang digunakan untuk menyebut bubuk yang sangat halus dan biasanya dipakai untuk bahan kosmetik khususnya eyeshadow. Sejak 5000 tahun yang lalu, alkohol digunakan sebagai minuman dengan berbagai tujuan, seperti sarana untuk komunikasi transedental dalam upacara kepercayaan dan untuk memperoleh kenikmatan (Dewi, 2008; Dorland, 2005).
Alkohol adalah senyawa yang mempunyai gugus fungsi hidroksil yang terikat pada atom karbon jenuh. Alkohol mempunyai rumus umum ROH, dimana R merupakan alkil dan OH merupakan gugus hidroksi. Alkohol bisa berasal dari alkana, alkena maupun alkuna dengan adanya penggantian gugus alkil (substitusi) dengan gugus hidroksi pada atom karbon jenuh (propanol CH3-CH2-CH2-OH, 2-propenol CH2=CH-CH2-OH, dan 2-propunol CH≡C-CH2-OH). Alkohol dapat dianggap sebagai turunan air (H-O-H), dimana satu atom hidrogennya diganti dengan gugus alkil (Riswiyanto, 2009).
Menurut Fessenden (1997), berdasarkan jenisnya lakohol dapat ditentukan oleh posisi atau letak gugu OH pada rantai karbon utama. Ada tiga jenis alkohol yaitu alkohol primer, alkohol sekunder, dan alkohol tersier. Alkohol primer (1°) yaitu alkohol yang gugus -OH terletak pada C primer yang terikat langsung pada satu atom karbon yang lain contonya etanol. Alkohol sekunder (2°) yaitu alkohol yang gugus -OH nya terletak pada atom C sekunder yang terikat pada dua atom C yang lain contohnya 2-propanol. Alkohol tersier (3°) adalah alkohol yang gugus -OH nya terletak pada atom C tersier yang terikat langusng pada tiga atom C lain contohnya 2-metil-2-propanol.
B. Fenol
Fenol (C6H6OH) merupakan senyawa organik yang mempunyai gugus hidroksil yang terikat pada cincin benzena. Senyawa fenol memiliki beberapa nama lain seperti asam karbolik, fenat monohidroksibenzena, asam fenat, asam fenilat, fenil hidroksida, oksibenzena, benzenol, monofenol, fenil hidrat, fenilat alkohol, dan fenol alkohol (Nair et al, 2008). Fenol memiliki rumus struktur sebagai berikut (Poerwono, 2012).
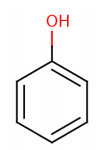
Fenol adalah zat kristal yang tidak berwarna dan memiliki bau yang khas. Senyawa fenol dapat mengalami oksidasi sehingga dapat berperan sebagai reduktor (Hoffman et al.,1997). Fenol bersifat lebih asam bila dibandingkan dengan alkohol, tetapi lebih basa daripada asam karbonat karena fenol dapat melepaskan ion H+dari gugus hidroksilnya. Lepasnya ion H+menjadikan anion fenoksida C6H5O-dapat melarut dalam air.Fenol mempunyai titik leleh 41C dan titik didih 181C. Fenol memiliki kelarutan yang terbatas dalam air yaitu 8,3 gram/100 mL (Fessenden, 1992).
C. Keasaman Serta Kebasaan Alkohol dan Fenol
Seperti halnya air alkohol dan fenol merupakan asam lemah. Gugus hidroksil dapat bertindak sebagai pendonor proton, dan disosiasi terjadi mirip seperti pada air. Basa konjugat suatu alkohol ialah ion alkoksida (contohnya, ion metoksida dari metanol, ion etoksida dari etanol, dan seterusnya). Metanol dan etanol memiliki keasaman yang hampir sama dengan air; alkohol meruah seperti t-butil alkohol sedikit lebih lemah karena keruahanya membuatnya sukar disolvasi, tidak seperti ion alkoksidanya. Fenol jauh lebih asam dari pada etanol.
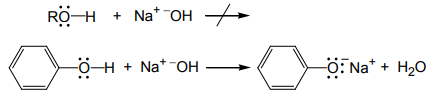
Fenol adalah asam yang lebih kuat dari pada alkohol terutama karena io fenoksidanya distabilkan oleh resonansi. Muatan negatif pada ion alkoksida terkonsentrasi pada atom oksigen, tetapi muatan negatif pada ion fenoksida dapat didelokalisasi pada posisi cincin orto dan para melalui resonansi.
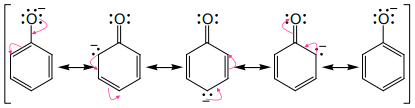
Oleh karena itu ion fenoksida terstabilka dengan cara ini, mkaa kesetimbangan untuk pembentukannya lebih disukai dibandingkan pada ion alkoksida. Jadi, fenol merupakan asam yang lebih kuat daripada alkohol.
Gugus fungsi alkohol dan fenol tidak saja berfungsi sebagai asam lemah melainkan juga sebagai basa lemah. Golongan tersebut memilki pasangan elektron bebas pada oksigen dan dengan demikian merupakan basa Lewis. Golongan ini dapat diprotonasi oleh asam kuat. Produknya, analog dengan ion oksonium, H3O+, yaitu ion alkiloksonium (Hart dan Craine, 2003).
D. Kelarutan
Kelarutan atau solubilitas adalah kemampuan suatu zat kimia tertentu, zat terlarut (solute), untuk larut dalam suatu pelarut (solvent). Kelarutan dinyatakan dalam jumlah maksimum zat terlarut yang larut dalam suatu pelarut pada kesetimbangan. Larutan hasil disebut larutan jenuh. Zat-zat tertentu dapat larut dengan perbandingan apapun terhadap suatu pelarut (Effendi, 2003).
Kelarutan adalah fungsi sebuah parameter molekul. Pengionan struktur dan ukuran molekul stereokimia dan struktur elektronik. Semuanya akan mempengaruhi antar aksi pelarut dan terlarut, seperti pada bagian terdahulu, air membentuk ikatan hydrogen dengan ion atau dengan senyawanon ionik, sedangkan polar melalui gugus – OH, -NH, atau dengan pasangan elektron tak mengikat pada atom oksigen atau nitrogen. Ion atau molekulakan memperoleh sampel hidrat dan akan memisah dari bongkahan zat padat dan artinya melarut (Thomas, 1992).
Menurut Sukardjo (1977), substansi polar cenderung lebih miscible atau soluble dengan substansi polar lainnya.Substansi nonpolar cenderung untuk miscible dengan substansi nonpolar lainnya, dan tidakmiscible dengan substansi polar lainnya. Menurut Martin (2008), pelarut polar melarutkan zat terlarut ionik dan zat polar lainnya. Sesuai dengan itu, air bercampur dengan alkohol dalam segala perbandingan dan melarutkan gula dan senyawa polihidroksi yang lain .Pelaru nonpolar tidak dapat mengurangi gaya tarik-menarik antara ion-ion elektrolit kuatdan lemah, karena tetapan dieektrik pelarut yang rendah. Pelarut juga tidak dapatmemecahkan ikatan kovalen dan elektrolit yang terionisasi lemah karena pelarut aprotik, dandapat membentuk jembatan hidrogen dengan nonelektrolit .Pelarut semipolar seperti keton dan alkohol dapat menginduksi suatu derajat polaritastertentu dalam molekul pelarut nonpolar, sehinga menjadi dapat larut dalam alkohol, contohnya benzena yang mudah dapat dipolarisasikan.
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum alkohol dan fenol ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum alkohol dan fenol ini, sebagai berikut:
Alat
- tabung reaksi
- rak tabung reaksi
- pipet tetes
- penangas air
Bahan
- aquades
- n-heksana
- metanol
- etanol
- 1-propanol
- 2-propanol
- amil alkohol
- 1-butanol
- 2-butanol
- 2-metil-2-propanol
- fenol
- butil alkohol
- isopropil alkohol
- asam asetat
- Na2CO3
- NaHCO3
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum alkohol dan fenol :
a. Kelarutan dalam air dan n-heksana
- Siapkan dua buah tabung reaksi
- Masukkan 0,5 ml air dan 0,5 ml n-heksana pada masing-masing tabung reaksi.
- Tambahkan 10 tetes metanol pada kedua tabung reaksi
- Kocok da perhatikan kelarutannya
- Ulangi langkah 1 – 4 dengan menggunakan alkohol yang lain (etanol, 1-propanol, 2-propanol, amil alkohol, 1-butanol, 2-butanol, 2-metil-2-propanol) dan fenol.
b. Membedakan alkohol primer, alkohol sekunder, dan alkohol tersier dengan pereaksi Lucas
- Siapkan empat buah tabung reaksi
- Masukkan 1 ml pereaksi Lucas pada semua tabung
- Tambahkan 1 ml 1-butanol, 2-butanol, 2-metil-2propanol, dan fenol pada masing-masing tabung reaksi.
- Kocok, biarkan 3-5 menit
- Lakukan pemanasan bila perlu dan catat perubahan
c. Reaksi dengan Na2CO3 dan NaHCO3
- Siapkan empat buah tabung reaksi
- Masukkan 1ml butil alkohol pada tabung reaksi 1, 1ml isopropil alkohol pada tabung reaksi 2, 1ml fenol pada tabung reaksi 3, 1ml asam asetat pada tabung reaksi 4
- Tambahkan 0,5ml Na2CO3 pada setiap tabung
- Kocok, biarkan 3-5 menit, dan catat perubahan
- Ulangi langkah 1 – 4 dan ganti Na2CO3 dengan NaHCO3
d. Reaksi dengan FeCl3
- Siapkan empat buah tabung reaksi
- Masukkan 1ml metanol pada tabung reaksi pertama, 1ml etanol pada tabung reaksi kedua, 1ml 2-butanol pada tabung reaksi ketiga, dan 1ml fenol pada tabung reaksi keempat
- Tambahakn 0,5ml FeCl3 pada setiap tabung reaksi
- Amati dan catat perubahan yang terjadi
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
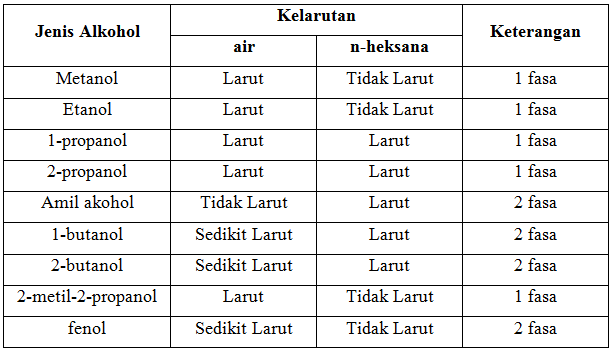
a. Kelarutan dalam air dan n-heksana
b. Membedakan alkohol primer, alkohol sekunder, dan alkohol tersier dengan pereaksi Lucas

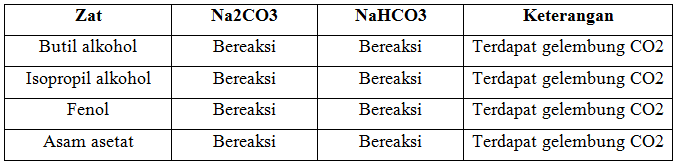
c. Reaksi dengan Na2CO3 dan NaHCO3
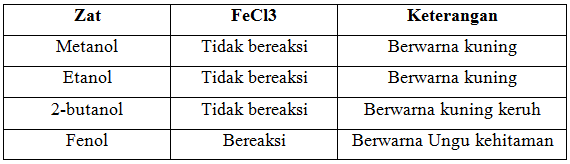
d. Reaksi dengan FeCl3
B. Pembahasan
Adapun pembahasan dalam laporan praktikum alkohol dan fenol ini adalah sebagai berikut :
Pada praktikum kimia organik alkohol dan fenol kali ini, kami melakukan empat percobaan yakni, kelarutan dalam air dan n-heksana; membedakan alkohol primer, alkohol sekunder, dan alkohol tersier dengan pereaksi Lucas; reaksi dengan Na2CO3 dan NaHCO3; dan reaksi dengan FeCl3.
a. kelarutan dalam air dan n-heksana
Alkohol dan fenol mempunyai rumus struktur R-OH. Alkohol merupakan senyawa organik hidroksilat dimana gugus -OH terikat pada atom karbon alifatik. Sedangkan fenol merupakan suatu senyawa organik karboksilat dimana gugus -OH terikat pada cincin aromatis.
Pada percobaan ini, kami bertujuan untuk menganalisis kelarutan alkohol dan fenol dalam pelarut air yang bersifat polar dan n-heksana yang bersifat nonpolar. percobaan ini akan merujuk kepada prinsip like dissolve like yang bermakna suatu zat hanya akan larut pada pelarut yang sesuai. Dengan kata lain, senyawa polar hanya akan larut dalam senyawa polar dan senyawa nonpolar hanya akan larut dalam senyawa nonpolar.Selain itu kelarutan dipengaruhi oleh beberapa faktor antara lain tetapan dielektrik, dapat tidaknya membentuk ikatan hidrogen, panjang rantai atom karbon, kemiripan struktur dan lainya.
Dari hasil pengamatan, metanol, etanol dan 2-metil-2propanol larut dalam air dan tidak larut dalam n-heksana. Ketiga larutan ini membentuk 1 fasa. Hal ini karena metanol dan etanol memiliki gugus alkil berantai pendek, sehingga tidak merubah tingkat keelektronegatifan, dan gugus hidroksil -OH pada metanol tersebut mengambil bagian yang lebih besar dalam molekulnya. Metanol, etanol, dan 2-metil-2-propanol bersifat polar. Reaksi metanol dan etanol dengan air :
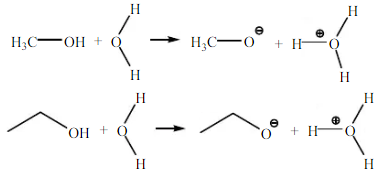
Reaksi 2-metil-2propanol dengan air :
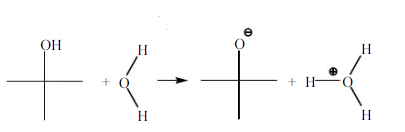
Pada 1-propanol dan 2-propanol dapat larut dalam air maupun n-heksana, dan membentuk 1 fasa. Hal ini berarti kedua senyawa tersebut merupaka senyawa semi polar. Berdasarkan teori 1-propanol dan 2-propanol merupakan senyawa polar dimana keduanya dapat larut dalam senyawa polar maupun nonpolar. Reaksi 1-propanol dan 2-propanol dengan air :
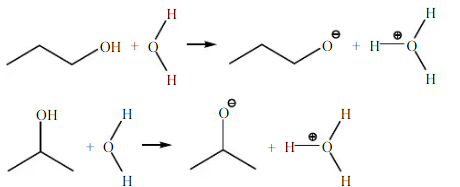
Pada amil alkohol (n-pentanol) didapatkan tidak larut dalam air namun larut dalam n-heksana. Secara teoritis amil alkohol sukar larut dalam air, dan dapat bercampur dengan pelarut organik. Gugus alkil yang dimiliki amil alkohol lebih mendominasi molekul yang dapat mengganggu pembentukan ikatan hidrogen antara gugus hidroksil dengan air, sehingga sukar larut dalam senyawa polar (air), dan dapat larut pada senyawa nonpolar (n-Heksana). Kelarutan amil alkohol adalah 27 g/L (pada suhu 20C). Seperti yang dijelaskan sebelumnya karena amil alkohol memiliki gugus alkil berantai sedang, sehingga keelektronegatifannya sedikit berubaha akibat pengaruh ketidakpolaran yang dimiliki gugus alkil, sehingga gugus hidroksil (-OH) dan gugus alkil (-R) pada zat tersebut mengambil bagian yang hampir sama besar dalam molekulnya yang menyebabakan bersifat semi polar, yang seharusnya amil alkohol dapat sedikit larut dalam air. Maka berdasarkan teori terdapat kesalahan dalam proses praktikum, sehingga tidak didapatkan hasil yang sesuai. Reaksi amil alkohol dengan air :
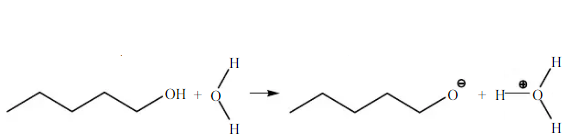
Pada saat 1-butanol dan 2-butanol direaksikan dengan air memberikan hasil sedikit larut, dan ketika direaksikan dengan n-heksana larut. Menurut teori senyawa alkohol yang berantai pendek atau memiliki atom C 1 – 5 akan mempunyai sifat menyerupai air yang berarti dapat larut dalam beberapa pelarut polar seperti air.
Kelarutan yang didapat pada fenol adalah, sedikit larut dalam air dan larut dalam n-heksana. Menurut teori fenol memilki kelarutan terbatas dalam air, dengan kelarutan 8,3g/ 100ml. Fenol memiliki sifat yang cenderung asam, berarti fenol merupakan senyawa polar. Hal ini pula yang membuat fenol dapat larut dalam pelarut air. Karena hasil yang didapat fenol sedikit larut dalam air, maka dapat dikatakan bahwa fenol larut dalam air namun dalam jumlah yang terbatas. Faktor perbandingan pelarut dan zat terlarut harus diperhatikan untuk mendapatkan hasil yang diinginkan.
Dari hasil yang didapatkan, kepolaran alkohol berkurang secara bertahap, sesuai bertambahnya gugus karbonil dan dapat bersifat semi polar bahkan bersifat nonpolar. Adanya gugul -OH dalam air, membuat alkohol memiliki polaritas yang hampir sama dengan polaritas air, sehingga alkohol dapat larut dalam air. Namun kepolaran yang dimiliki oeh alkohol tidak akan sebanding dengan polaritas air. Hal ini dipengaruhi oleh kehadiran gugus alkil -R pada molekulnya.
b. Membedakan alkohol primer, alkohol sekunder, dan alkohol tersier dengan pereaksi Lucas
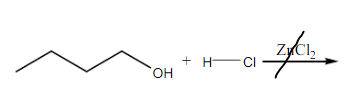
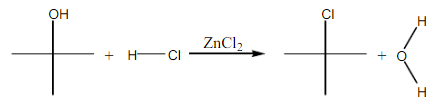
Pada percobaan kedua, bertujuan untuk membedakan alkohol primer, alkohol sekunder, dan alkohol tersier dengan menggunakan pereaksi Lucas. Reagen Lucas merupakan campuran HCl dan ZnCl2. ZnCl2 berfungsi sebagai katalis asam Lewis. HCl berfungsi melarutkan alkohol dan juga menyumbangkan Cl- pada pembuatan alkil klorida, serta Cl2 berfungsi sebaga katalisator dalam reaksi Lucas yang membantu pemekatan warna pada reaksi. Prinsip dari pereaksi Lucas adalah mengidentfikasi jenis alkohol dengan menambahkan reagen Lucas yang akan terjadi reaksi subtitusi gugu OH dengan Cl yang ada pada reagen sehingga terbentuk alkil klorida yang tidak larut dan mengendap. Gugus OH yang lepas akan bereaksi dengan H+ yang berasal dari reagen mementuk H2O. Sedangkan gugus Cl- mengganti tempat OH membentuk alkil klorida yang tidak larut. Alkohol primer tidak akan bereaksi, alkohol sekunder bereaksi lambat dan harus dengan pemanasan, sedangkan alkohol tersier dapat bereaksi dengan cepat tanpa pemanasan.
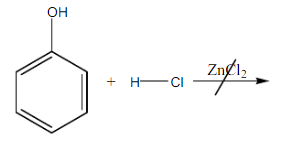
Sampel yang akan di uji pada pereaksi Lucas adalah 1-butanol sebagai alkohol primer, 2-butanol sebagai alkohol sekunder, 2-metil-2-propanol sebagai alkohol tersier dan fenol sebagai pembanding. Setelah dilakukan uji didapatkan bahwa 1-butanol tidak bereaksi, kemudian dicoba perlakuan dengan pemanasan namun 1-butanol tetap tidak bereaksi, karena 1-butanol merupakan alkohol primer. Mekanisme reaksi yang terjadi pada uji Lucas adalah reaksi antara sampel dengan HCl dan katalis ZnCl2. Namun, pada alkohol primer, energi yang dimiliki atom C primer untuk mengikat gugus OH karena atom C hanya mengikat satu atom C lain, sehingga sulit untuk disubtitusi. Hal ini yang menyebabkan alkohol primer tidak akan bereaksi dengan reagen Lucas. Reaksi yang terjadi adalah :
Sama halnya dengan fenol yang juga memberikn hasil negatif yakni tidak bereaksi walaupun juga dilakukan pemanasan. Hal ini sesuaai dengan literatur, yakni fenol merupakan golongan benzena sehingga tidak mungkin dapat bereaksi dengan uji Lucas. Hal ini disebabkan karena gugus hidroksi pada fenol yang sukar diputuskan akibat adanya delokalisasi elektron, atau bisa disebut dengan pengaruh resonansi. Resonansi terjadi karena adanya dehidrogenisasi, yang diakibatkan susunan ikatan rangkap fenol yang terkonjugasi sempurna (ikatan selang-seling rangkap tunggal-rangkap dua). Reaksi fenol dengan reagen Lucas :
Pada 2-butanol terjadi reaksi dengan reagen Lucas, reaksi harus dibantu dengan pemanasan, walaupun demikian reaksi berjalan lambat. Diperlukan pemanasan sekitar 15 menit dan baru terbentuk 2 lapisan yakni larutan yang berwarna bening dan berwarna keruh. Hal ini sesuai dengan literatur yakni alkohol sekunder akan bereaksi dengan reagen Lucas secara lambat dan harus dibantu dengan pemanasan. Reaksi yang terjadi adalah :
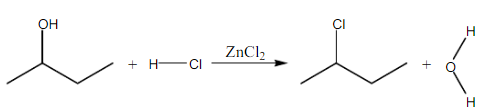
2-metil-2-propanol bereaksi cepat dengan reagen Lucas. Tanpa pemanasanpun 2-metil-2-propanol langsung bereaksi dengan reagen Lucas. Hal ini disebabkan karena pada alkohol tersier sangat memungkinkan untuk terjadinya pemutusan dan pelepasan gugus hidroksil untuk berlangsungnya reaksi substusi karena kestabilan atom karbon yang berikatan langsung dengan gugus hidroksil dapat diminimalisir oleh atom karbon lain yang berada disekelilingnya. Maksudnya, alkohol tersier lebih banyak memiliki atom karbon yang menyebabkan kurangnya kestabilkan atom karbon yang berikatan langsung dengan gugus hidroksil. Reaksi yang terjadi adalah :
c. Reaksi dengan Na2CO3 dan NaHCO3
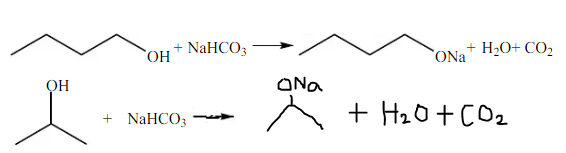
Praktikum yang ketiga mengenai pereaksian alkohol dan fenol dengan Na2CO3 dan NaHCO3. Percobaan ini dilakukan untuk mengetahui keasaman dari alkohol dan fenol dengan cara mereaksikannya menggunakan basa kuat Na2CO3 dan NaHCO3. Prinsip dari percobaan ini adalah jika zat yang direaksikan tersebut bersifat asam, maka zat tersebut dapat bereaksi dengan kedua basa tersebut.
Zat yang digunakan dalam percobaan ini adalah butil alkohol, isopropil alkohol, fenol, dan asam asetat. Masing-masing zat sebanyak 1 ml direaksikan dengan 0,5ml Na2CO3 kemudian, dikocok. Hal yang sama dilakukan juga dengan mengganti pereaksi Na2CO3 dengan NaHCO3. Hasil yang didapatkan pada butil alkohol, isopropl alkohol, fenol, dan asam asetat adalah menghasilkan gelembung CO2. Semua zat bereaksi yang membedakan adalah banyak sedikitnya gelembung yang tercipta.
Ketika butil alkohol dan isopropil alkohol direaksikan dengan Na2CO3 dan NaHCO3 menghasilkan natrium alkoksida, air, dan gelembung gas CO2, hal ini membuktikan bahwa butil alkohol bersifat asam. Hal ini dikarenakan saat alkohol bereaksi dengan Na2CO3 dan NaHCO3, alkohol melepaskan proton (H+) atau bertindak sebagai asam, sesuai dengan teori asam-basa Bronsted-Lowry, bahwa asam adalah suatu spesies kimia yang melepaskan suatu proton kepada spesies kimia lain. Kemudian Na+ berikatan dengan O- membentuk natrium alkoksida. Reaksi terjadi, ditandai dengan adanya pelepasan gas CO2 yang membuktikan penguraian Na2CO3dan NaHCO3. Yang membedakan reaksi antara butil alkohol dengan isopropil alkohol adalah banyaknya gelembung. Butil alkohol menghasilkan lebih sedikit gelembung jika dibandingkan dengan isopropil alkohol. Tingkat keasaman alkohol ditentukan oleh panjangnya rantai karbon yang terikat pada gugus hidroksil. Semakin panjang rantai karbonnya maka tingkat keasamannya akan semakin rendah, begitupun sebaliknya semakin pendek rantai karbon makan semakin rendah tingkat keasaman alkohol tersebut. Hal ini karena semakin panjang rantai karbon pada alkil maka sifat gaya dorong elektronnya semakin besar sehingga ion H+ pada gugus hidroksil akan sulit terlepas. Reaksi yang terjadi adalah :
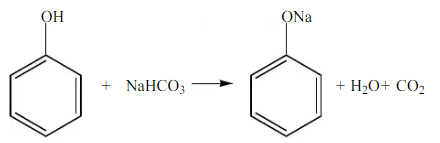
Fenol dan asam asetat dapat bereaksi dengan Na2CO3 dan NaHCO3 dikarenakan kedua zat ini merupakan asam lemah, namun keasaman fenol lebih rendah jika dibandingkan dengan asam asetat, dan fenol memiliki tingkat keasaan diatas alkohol. Terbentuknya ion fenoksida menyebabkan fenol lebih bersifat asam dibandingkan dengan alkohol, karena ionfenoksida dimantapkan dengan resonansi. Sehingga tingkat keasaman dapat ditulis : Asam asetat > fenol > alkohol. Reaksi yang terjadi pada fenol dan asam asetat adalah :
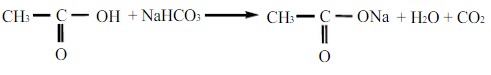
d. Reaksi dengan FeCl3
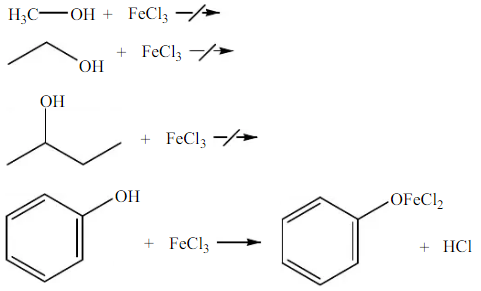
Pada percobaan terakhir, dilakukan pereaksian alkohol dan fenol dengan FeCl3. Percobaan ini dilakukan untuk mengetahui senyawa yang merupakan alkoksik kuat atau lemah, dengan melihat perubahan warna saat reaksi terjadi, jika bereaksi larutan akan berubah menjadi ungu kehitaman. Selain percobaan ini juga dapat digunakan untuk membedakan alkohol alfatik dengan alkohol aromatik.
Setelah dilakukan percobaan didapatkan pada metanol, etanol, dan 2-butanol yang dicampurkan dengan FeCl3, larutan berwarna kuning, dan 2-butanol menghasilkan kuning keruh. Hal ini menunjukkan bahwa alkohol tidak bereaksi dan larut dengan FeCl3. Warna kekuning-kuningan adalah warna dari larutan FeCl3, selain itu hal ini menunjukkan bahwa alkohol merupakan alkoksi lemah, karena tidak membentuk senyawa kompleks. Sedangkan setelah fenol direaksikan dengan FeCl3 menghasilkan warna ungu kehitaman, yang berarti fenol merupakan alkoksi kuat. Hal ini karena telah terbentuk dari Fe3+ dengan fenol. Fenol merupakan senyawa yang mengandung gugus hidroksil yang terikat pada karbon tak jenuh, sehingga dapat bereaksi dengan FeCl3, dan membentuk senyawa kompleks berwarna ungu kehitaman. Reaksi yang terjadi adalah :
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum alkohol dan fenol dapat disimpulkan bahwa :
- Metanol, etanol dan 2-metil-2-propanol larut dalam air namun tidak larut dalam n-heksana. 1-propanol, 2-propanol dan amil alkohol larut dalam air dan larut dalam n-heksana. 1-butanol dan 2-butanol sedikit larut dalam air dan larut dalam n-heksana. Fenol memiliki kelarutan yang terbatas dalam air dan larut dalam n-heksana.
- 1-butanol (alkohol primer tidak bereaksi dengan reagen Lucas, 2-butanol (alkohol sekunder) bereaksi lambat dan butuh pemanasan dengan reagen Lucas, 2-metil-2-propanol (alkohol tersier) bereaksi cepat dengan reagen Lucas, dan fenol tidak bereaksi dengan reagen Lucas.
- Tingakat keasaman alkohol dan fenol dapat dilihat dengan pereaksian menggunakan Na2CO3 dan NaHCO3. Sehingga tingkat keasaman dapat ditulis : Asam asetat > fenol > alkohol (isopropil alkohol > butil alkohol).
- Metanol, etanol, dan 2-butanol merupakan alkoksi lemah, sedangkan fenol merupakan alkoksi kuat berdasarkan reaksi dengan FeCl3 yang menghasilkan warna ungu kehitaman.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- A.N.S Thomas. (1992). Tanaman Obat Tradisional 2. Yogyakarta: Kanisius
- Alfred, Martin. 2008. Farmasi Fisika Dasar-Dasar Farmasi Fisik dalam IlmuFarmasetik Ed. Ketiga jilid 2. Jakarta : UI Press
- Dewi, N. 2008. Perioperatif Pada Pasien Dalam Pengaruh Alkohol .http://butterflystillfly. wordpress.com/2009/ 02/05/periopera tif-pada-pasien-d alam-pengar uh-al kohol/ Diakses pada 13 september 2009
- Dorland, W. 2005. Kamus Kedokteran Dorland. EGC. Jakarta
- Effendi, H. 2003. Telaah Kualitas Air bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Cetakan Kelima. Yogjakarta : Kanisius.
- Fessenden. 2009. Kimia Organik Jilid 1 Edisi Ketiga. Jakarta: Erlangga
- Hart, H., craine, L.E. and Hart. D.J. 2003. Kimia Organik Edisi Kesebelas. Erlangga. Jakarta.
- Hoffman, M.R., Martin, S.T., Choi, W., and Bahneman, D.W. 1997. Environmental Application of Semiconductor Photocatalysis. J. Chem. Rev., 69 96
- Nair, C. I., Jayachandran, K., Shashidhar, S.. 2008. Biodegradation of Phenol. African Journal of Biotechnology, Vol: 7 (25), page: 4951-4958
- Riswiyanto. 2009. Kimia Organik. Jakarta: Erlangga
- Sukardjo. 1997.’’Kimia Fisika I’’ . Universitas Indonesia : Jakarta
