Download Laporan Praktikum Koloid dan landasan teori mengenai koloid lengkap dengan pembahasan dalam format PDF. Laporan Praktikum ini merupakan kelanjutan dari Laporan Praktikum biokimia yang pernah admin bahas minggu lalu, laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
BAB I PENDAHULUAN
Tujuan :
Mengetahui sifat-sifat koloid
Latar Belakang
Dalam larutan sejati, seperti larutan gula atau larutan garam, partikel zat terlarut mengandung ion atau molekul tunggal. Pada sisi lain ada yang disebut dengan suspensi,yang mana partikelnya mengandung lebih dari satu molekul dan cukup besar untuk dilihat oleh mata atau dibawah mikroskop. Diantara keduanya akan ditemukan suatu koloid, yang mana partikelnya mungkin mengandung lebih dari satu molekul tetapi tidak cukup besar untuk dapat dilihat dengan mikroskop biasa.
Koloid banyak dijumpai dalam kehidupan sehari-hari, seperti di alam, industri, makhluk hidup, dan pertanian. Kita sering menggunakan bahan-bahan kimia berbentuk koloid. Bahan-bahan kimia tersebut dibuat oleh industri. Mengapa harus koloid? Hal ini karena koloid merupakan satu-satunya cara untuk menyajikan suatu campuran dari zat-zat yang tidak saling melarutkan secara “homogen” dan stabil (pada tingkat makroskopis atau tidak mudah rusak). Di industri, aplikasi koloid untuk produksi cukup luas. Sifat karakteristik koloid yang penting, yaitu dapat digunakan untuk mencampur zat-zat yang tidak dapat saling melarutkan secara homogen dan bersifat stabil untuk produksi skala besar. Dalam praktikum ini akan dibahas mengenai sifat-sifat penting koloid yang jarang diketahui.
BAB II KAJIAN PUSTAKA
A. Pengertian Koloid
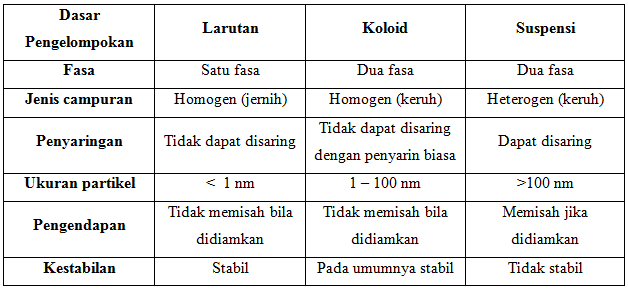
Koloid adalah suatu bentuk campuran yang keadaanya terletak antara larutan dan suspensi (campuran kasar). Nama koloid diberi oleh Thomas Graham pada tahun 1861. Istilah itu berasal dari bahasa Yunani, yaitu ”kolla” dan ”oid”. Kolla berarti lem, sedangkan oid berarti seperti. Koloid dan suspensi merupakan campuran yang bersifat heterogen, sedangkan larutan merupakan campuran yang bersifat homogen. Koloid memiliki sifat yang berbeda dengan suspensi dan larutan. Sifat khusus koloid timbul akibat partikelnya yang yang lebih besar dari pada partikel larutan.
Perbendaan antara larutan sejati, koloid, dan suspensi dapat dilihat pada tabel berikut.
Larutan koloid adalah larutan homogen yang mengangandung partikel dengan berat molekul besar yaitu >20.000 dalton sehingga dapat digunakan untuk mempertahankan tekanan onkotik dan volume intravaskuler. Partikel ini tidak dapat digabungkan atau dipisahkan dengan filtrasi atau sentrifugasi seperti komponen dari darah. Koloid dapat dipisahkan menjadi dua kelompok yaitu golongan protein dan non-protein (disebut juga menjadi golongan derivate plasma dan semisintetis). Larutan koloid jenisnya ada bermacam-macam seperti albumin (merupakan satu-satunya koloid yang digunakan untuk resusitasi yang berasal dari human plasma), dekstran, gelatin dan juga HES dimana penggunaan masingmasing larutan mempunyai keuntungan dan kelemahan sendiri-sendiri.
Sistem koloid terdiri atas fase terdipersi dengan ukuran tertentu dalam medium pendispersi. Zat yang didispersikan disebut fase terdispersi, sedangkan medium yang digunakan untuk mendispersikan disebut medium pendispersi. Ukuran partikel koloid berkisar antara 10-7 – 10-5 cm (1-100 nm). Ukuran inilah yang membedakan koloid dengan campuran lainnya (larutan dan suspensi).
B. Jenis-Jenis Koloid
Sistem koloid dapat dikelompokkan berdasarkan fase terdispersinya menjadi tiga, yaitu sol (fase terdispersi berupa zat padat), emulsi (fase terdispersi berupa zat cair), dan buih (fase terdispersi berupa gas). Selanjutnya sol, emulsi dan buih dikelompokkan lagi berdasarkan medium pendispersinya.
- Sol: sol padat, sol cair (sol), dan sol gas (aerosol padat).
- Emulsi: emulsi padat (gel), emulsi cair (emulsi), dan emulsi gas (aerosol cair).
- Buih: buih padat dan buih cair (buih).
Bila dijabarkan menjadi seperti berikut :
- Sol : sistem koloid ini terbentuk dari fasa terdispersi berupa padatan dan fasa pendispersinya berupa cairan. Contohnya: sol emas, tinta, dan cat.
- Sol padat : Sistem koloid ini terbentuk dari fasa terdispersi berupa padatan dan fasa pendispersinya padatan. Contohnya: gelas bewarna, dan intan hitam.
- Aerosol padat : Sistem koloid ini terbentuk dari fasa terdispersi berupa padatan dan fasa pendispersinya berupa gas. Contohnya: asap dan debu.
- Emulsi : Sistem koloid ini terbentuk dari fasa terdispersi berupa cairan dan fasa pendispersinya cairan. Contohnya: susu, santan, dan minyak ikan.
- Emulsi padat : Sistem koloid ini terbentuk dari fasa terdisfersi berupa cairan dan fasa pendispersinya berupa padatan. Contohnya: jelly, mutiara, dan keju.
- Aerosol cair : Sistem koloid ini terbentuk dari fasa terdispersi berupa cairan dan fasa pendispersinya berupa gas. Contohnya: kabut, awan, dan hair spray.
- Buih : Sistem koloid ini terbentuk dari fasa terdispersi berupa gas dan fasa pendispersinya berupa cairan. Contohnya: buih sabun, dank rim kocok.
- Buih padat : Sistem koloid ini terbentuk dari fasa terdispersi berupa gas dan fasa pendispersinya berupa padatan. Contohnya: karet busa dan batu apung.
C. Sifat-Sifat Koloid
Sistem koloid mempunyai sifat-sifat khas yang berbeda dari sifat larutan ataupun suspensi. Berikut adalah pembahasan mengenai sifat-sifat koloid.
1. Efek Tyndall
Bila suatu larutan disinari dengan seberkas sinar tampak maka berkas sinar tadi akan diserap dan hanya sebagian kecil yang dipancarkan. Sedangkan bila seberkas sinar dilewatkan pada sistem koloid, maka sinar tersebut akan dihamburkan oleh partikel koloid.
2. Gerak Brown
Gerak Brown, adalah gerak zig-zag partikel koloid secara terusmenerus dengan acak, terjadi sebagai akibat adanya tumbukan dari molekul-molekul pendispersi terhadap partikel terdispersi, sehingga partikel terdispersi akan terlontar. Hal ini pertama kali diamati oleh Robert Brown (1773-1858) seorang botani Inggris tahun 1827.
3. Elektroforesis
Elektroforesis adalah peristiwa bergeraknya partikel koloid dalam medan listrik. Apabila kedalam sistem koloid dimasukkan dua batang elektrode, kemudian dihubungkan dengan sumber arus searah, maka partikel koloid akan bergerak kesalah satu elektrode tergantung pada jenis muatannya. Koloid bermuatan negatif akan bergerak ke anode (elektrode positif), sedangkan yang bermuatan positif akan bergerak ke katode (elektrode negatif). Dengan demikian, elektroforesis dapat digunakan untuk menentukan jenis muatan koloid. Contohnya adalah identifikasi DNA.
4. Adsorpsi
Adsorpsi adalah kemampuan partikel koloid untuk menyerap ion sehingga ion tersebut menempel pada permukaan koloid. Akibatnya, pertikel koloid tersebut menjadi bermuatan sesuai dengan ion yang diadsorpsi. Sifat adsorpsi koloid telah banyak digunakan dalam berbagai bidang, misalnya pada proses penjernihan air minum, pemurnian gula tebu, dan pembuatan obat norit.
5. Koagulasi
Koagulasi adalah penggumpalan koloid karena peristiwa mekanis. Koagulasi dapat dilakukan dengan 3 cara yaitu pemanasan atau pendinginan, penambahan elektrolit, dan dengan cara pencampuran larutan koloid yang berlawanan muatan.
6. Koloid pelindung
Koloid Pelindung, merupakan koloid yang ditambahkan ke dalam sistem koloid agar menjadi stabil. Misalnya penambahan gelatin pada pembuatan es krim dengan maksud agar es krim tidak cepat memisah sehingga tetap kenyal.
7. Dialisis
Dialisis adalah suatu teknik pemurnian koloid yang didasarkan pada perbedaan ukuran partikel-partikel koloid. Dialisis dilakukan dengan cara menempatkan dispersi koloid dalam kantong yang terbuat dari membrane semipermeabel, seperti kertas selofan dan perkamen.
8. Koloid liofil dan liofob
Koloid liofil adalah koloid yang fase terdispersinya suka menarik medium pendispersinya, yang disebabkan gaya tarik antara partikel-partikel terdispersi dengan medium pendispersinya kuat. Koloid liofob adalah sistem koloid yang fase terdispersinya tidak suka menarik medium pendispersinya. Bila medium pendispersinya air maka koloid liofil disebut koloid hidrofil, sedangkan koloid liofob disebut koloid hidrofob.
D. Pembuatan Koloid
a. Cara kondensasi
Pembuatan koloid dengan cara penggumpalan partikel larutan sejati. Penggumpalan partikel ini dapat dilakukan dengan cara sebagai berikut:
- Reaksi redoks, adalah reaksi yang disertai perubahan bilangan oksidasi. Pembuatan sol belerang dari reaksi antara hydrogen sulfida (H2S) dengan belerang dioksida (SO2). 2H2S (g) + SO2 (aq) → 2H2O (l) + 3S (s) (koloid)
- Hidrolisis, adalah reaksi suatu zat dengan air. Misalnya pembuatan sol Fe(OH)3 dari hidrolisis FeCl3. Apabila kedalam air mendidih ditambahkan larutan FeCl3 akan terbentuk sol Fe(OH)3. FeCl3 (aq) + 3H2O (l) → Fe(OH)3 (koloid) + 3HCl (aq)
- Dekomposisi rangkap, contohnya adalah pembuatan sol AgCl dibuat dengan mencampurkan larutan AgNO3 encer dalam larutan HCl encer. AgNO3 (aq) + HCl (aq) → AgCl (koloid) + HNO3 (aq)
- Penggantian pelarut, cara ini dilakukan dengan mengganti medium pendispersi sehingga fase terdispersinya yang semula larut menjadi berukuran koloid. Misalnya larutan jenuh kalsium asetat jika dicampurkan dengan alkohol akan terbentuk suatu koloid berupa gel.
b. Cara despersi
Dengan cara dispersi partikel kasar dipecah menjadi partikel koloid. Cara dispersi dapat dilakukan secara mekanik, peptisasi, atau dengan loncatan bunga listik ( busur breding).
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum koloid ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum koloid ini, sebagai berikut:
Alat
- gelas beker
- erlenmeyer
- tabung sentrifugasi
- senter
- kertas saring
- corong
- pengaduk
- neraca
Bahan
- garam dapur
- aquades
- susu cair
- tawas
- pasir
- HCl pekat
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum koloid :
- Masukkan 10gr garam dapur ke dalam erlenmeyer, kemudian larutkan dengan 100ml aquades, beri label sebagai erlenmeyer A.
- Masukkan 100ml susu cair ke dalam aquades, beri label sebagai erlenmeyer B.
- Masukkan 10gr pasir ke dalam erlenmeyer, kemudian tambahkan air goyang erlenmeyer, beri label sebagai erlenmeyer C
- Lakukan penyinaran dengan senter terhadap erlenmeyer A, amati jalan sinarnya. Lakukan hal yang sama pada erlenmeyer B dan C.
- Ambil 20ml campuran A, B, dan C. Saring masing-masing campuran dengan kertas saring. Amati filtrat yang diperoleh.
- Siapkan 2 tabung sentrifugi. Isi tabung pertama dengan campuran A dan tabung kedua dengan campuran B hingga dua pertiganya. Lakukan sentrifugasi selama 15 menit pada kecepatan 2000 – 3000 rpm. Amati perubahan yang terjadi.
- Ukur pH campuran A dan B. Turunkan pH masing-masing campuran sebanyak 2 satuan dengan menambahkan HCl pekat. Amati perubahan yang terjadi.
- Ambil 20ml masing-masing campuran A dan B. Masukkan dalam gelas beker terpisah. Tambahkan 2 gr tawas ke dalam tiap campuran, diamkan selama 20 menit. Amati perubahan yang terjadi.
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
B. Pembahasan
Adapun pembahasan dalam laporan praktikum koloid ini adalah sebagai berikut :
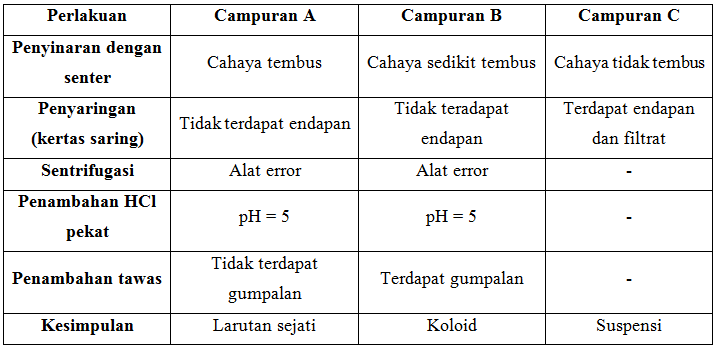
Pada praktikum kali ini kami melakukan praktikum mengenai koloid yang bertujuan untuk mengetahui sifat-sifat koloid. Koloid adalah suatu bentuk campuran yang keadaannya teletak anatar larutan dan suspensi. Secara makroskopis koloid tampak homogen, tetapi jika diamati dengan mikroskop ultra akan tampak heterogen, maka dapat dibedakan atas komponennya. Pada praktikum ini ada tiga komponen yang kami uji yaitu larutan garam (10gr garam dalam 100ml aquades) yang diberi label A, 100ml susu cair diberi label B, dan campuran pasir dan air (10 gr pasir dalam 100ml aquades) diberi label C. Kemudian pada setiap campuran kami beri beberapa perlakuan.
Pada perlakuan pertama kami menyinari masing-masing erlenmeyer A, B, dan C dengan menggunakan senter. Pada erlenmeyer A yang berisi larutan garam, terlihat cahaya yang tembus, berkas sinar diterukan satu arah. Dalam campuran ini berkas sinar hanya berjalan lurus tanpa penghaburan saat melewati larutan garam tersebut. Dapat diindikasikan bahwa campuran pada erlenmeyer A merupakan larutan sejati. Pada erlenmeyer B ketika diberikan cahaya senter cahaya disini tidak tembus dengan baik (sedikit tembus). Berkas sinar tersebut dihamburkan dalam mediumnya yang menyebabkan berkas sinar tersebut melebar dan menyebar. Hal ini disebabkan karena partikel-partikelnya mempunyai ukuran partikel yang relatif besar untuk dapat menghamburkan sinar tersebut. Dapat dikatakan bahwa susu cair merupakan koloid. Pada erlenmeyer C ketika seberkas cahay senter diberikan yang terjadi adalah cahaya tidak tembus, penghamburan cahaya sangat signifikan, dan belum sampai setengah dari badan erlenmeyer cahaya tidak lagi diteruskan. Hal ini terjadi karena partikel-partikel yang terdapat pada erlenmeyer C lebih besar lagi. Maka dapat dikatan pada campuran air dan pasir adalah suspensi.
Pada perlakuan yang pertama ini kami menggunakan prinsip dari efek Tyndall. Jika seberkas cahaya dilewatkan pada suatu sistem koloid, maka cahaya tersebut akandihamburkannya sehingga berkas cahaya tersebut akan kelihatan. Sedangkan jika cahayadilewatkan pada larutan sejati maka cahaya tersebut akan diteruskannya . Sifat koloid yangseperti inilah yang dikenal dengan efek Tyndall dan sifat ini dapat digunakan untukmembedakan koloid dengan larutan sejati.
Pada perlakuan selanjutnya kami melakukan penyaringan terhadap campuran A, B, dan C. Kami mengambil masing-masing 20ml campuran untuk disaring. Terdapat perbedaan hasil setelah kami melakukan proses penyaringan dengan kertas saring. Pada campuran A tidak terdapat endapan, hasil penyaringan tetap bening seperti semula. Pada campuran B memberikan hasil yang sama. Tidak terdapat endapan, dan hasil penyaringan tetap keruh. Sedangkan untuk campuran C terdapat endapan pada hasil penyaringan. Campuran ini bersifat heteroegen dan memiliki dua fase. Dapat dipastikan bahwa campuran C merupakan suspensi.
Untuk perlakuan ketiga agar dapat benar-benar membedakan antara larutan dan koloid maka kami melakukan percobaan dengan alat sentrifugasi. Pada campuran A dan B dimasukkan pada tabung sentrifugasi yang berbeda sebanyak dua pertiganya. Kemudian kedua campuran ini disentrifugasi selama 15 menit dengan kecepatan 2000-3000 rpm. Namun kami tidak mendapatkan hasil apa-apa dikarenakan alat yang kami gunakan error (terjadi kesalahan).
Selanjutnya pada perlakuan pengukuran pH, kami menggunakan HCl untuk menurunkan pH sebanyak 2 satuan pada campuran A dan campuran B. pH awal pada masing-masing campuran adalah 7 kemudian diturunkan pH dengan memberi beberapa tetes HCl pekat. pH diukur kembali dan didapat pH campuran adalah 5. terdapat perubahan setelah ditambahkan HCl pekat pada campuran A menjadi sedikit pekat namun tidak terlalu kentara. Pada campuran B terlihat sedikit menggumpal. Perlakuan terakhir adalah dengan menambahkan tawan pada campuran A dan B. Pada saat campuran A ditambahkan tawa terlihat campuran menjadi sedikit keruh namun tidak terbentuk endapan atau gumpalan. Pada campuran B, terlihat menjadi lebih kental dan terdapat gumpalan. Sifat koloid ini disebut koagulasi, yaitu peristiwa pengendapan atau penggumpalan koloid.
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum koloid dapat disimpulkan bahwa :
- Efek Tyndall merupakan salah satu sifat koloid dengan prinsip penghamburan cahaya. Dengan menjatuhkan seberkas cahaya senter campuran A dibuktikan sebagai larutan sejati, campuran B adalah koloid, dan campuran C adalah suspensi.
- Sifat larutan tidak dapat disaring, koloid tidak dapat disaring dengan penyaring biasa, dan suspendi dapat disaring.
- Penambahakn tawas dapat menggumpalkan koloid (susu cair), hal ini sesuai dengan sifat koloid koagulasi.
Download Laporan Praktikum [PDF]
Anda dapat mendownload Laporan Praktikum Kimia Koloid : Sifat-Sifat Koloid ini dalam format PDF dengan mengklik tombol download yang sudah kami sediakan di bawah.


Oky
Terimakasih dah mampir