BAB I PENDAHULUAN
Tujuan :
Adapun tujuan dalam praktikum golongan dan identifikasi unsur adalah sebagai berikut :
- Mengetahui keasaaman sifat unsur-unsur dalam tabel berkala
- Mengetahui uji nyala dan reaksi beberapa unsur alkali dan alkali tanah
- Mengetahui reaksi air klorin dan halida
- Mengetahui larutan anu yang mengandung unsur alkali atau unsur alkali tanah dan halida
Latar Belakang
Ketika mempelajadi sifat suatu unsur, dapat dilihat dari kecendrungan sifat-sifat ini dapat dikelompokkan menurut periode dan golongan sepanjang periode dari kiri ke kanan nomor atom bertambah dan muatan bertambah besar. Disini terlihat bahwa dari kiri ke kanan dalam suatu periode terjadi perubahan sifat dari logam ke bukan logam. Kemiripan sifat disebabkan adanya struktur elektron yang sama dalam kulit terluar sedangkan perbedaan sifat, dalam golongan disebabkan perbedaan dalam ukuran atomnya. Unsur-unsur dalam satu golongan mempunyai banyak persamaan sifat kimianya. Sifat-sifat kimia ditentukan oleh elektron valensinya yaitu elektron yang terdapat pada kulit lintasan yang terluar. Karena elektron valensi unsur yang segolongan sama, dengan sendirinya sifat kimianya juga sama.
Terdapat dua golongan besar dalam tabel periodik yakni golonga utama (golongan A), dan golongan transisi (golongan B). Pada golongan-golongan in dibagi lagi bedasarkan kesamaan sifat yang khas yakni berada pada satu kolom. Seperti golongan IA (alkali), IIA (alkali tanah) juga VIIA (halogen). golongan-golongan ini memiliki ciri khas masing-masing sehingga dapat dilakukan identifikasi unsur. Oleh karena itu, dilakukanlah praktikum golongan dan identifikasi unsur.
BAB II KAJIAN PUSTAKA
A. Unsur dan Golongan
Keberadaan unsur-unsur kimia di alam sangat melimpah. Sumber unsur-unsur kimia terdapat di kerak bumi, dasar laut, dan atmosfer, baik dalam bentuk unsur bebas, senyawa atau campurannya. Unsur-unsur kimia di alam dalam bentuk unsur bebasnya (tidak bersenyawa dengan unsur lainnya), diantaranya adalah platina (Pt), emas (Au), karbon (C), gas nitrogen (N2), oksigen (O2), dan gas-gas mulai. Adapun unsur-unsur lainnya ditemukan dalam bentuk bijih logam. Bijih logam merupakan campuran antara mineral yang mengandung unsur-unsur kimia dan pengotornya. Menurut Keenan (1984), sistem periodik unsur adalah sistem pengelompokan unsur berdasarkan hukum periodik, mencakup periode dan golongan keduanya saling berhubungan dan menentukan keperiodikan sifat unsur dan disajikan ke dalam bentuk tabel yag disebut tabel periodik unsur.
Tabel berkala unsur yang baru disusun berdasarkan nomor atom. Tabel berkala unsur ini menghasilkan baris yang disebut periode dan kolom yang disebut golongan. Golongan merupakan kolom yang berisi unsur-unsur yang mempunyai kemiripan sifat. Ada dua golongan pokok, yaitu golongan A disebut sebagai golongan utama dan golongan B disebut golongan transisi. Pada golongan A, nomor golongan menunjukan banyaknya elektron pada kulit terluar (Rahardjo, 2012).
B. Alkali dan Alkali Tanah
Alkali dan alkali tanah merupakan unsur logam yang sangat reaktif. Logam alkali adalah logam golongan IA yang terdiri dari Litium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr). Sedangkan logam alkali tanah terdiri dari Berilium (Be), Magnesium (Mg), Kalsium (Ca), Stronsium (Sr), Barium (Ba), Radium (Ra). Radium kadang tdak dianggap sebagai alkali tanah karena sifat radioaktif yang dimilikinya.
Ciri khas yang paling mencolok dari alkali adalah kereaktifannya yang luar biasa besar. Logam-logam yang sangat umum seperti natrium, kalium dan kalsium kurang dikenal baik karena logam-logam ini begitu aktif sehingga logam ini tak terdapat sebagai unsur bila bersentuhan dengan udara atau air. Tak satupun unsur logam IA dan IIA terdapat di alam dala keadaan unsurnya. Logam alkali mempunyai energi resonansi rendah dan kecenderungannya melepas elektron valensi tunggalnya. Logam alkali dapat bereaksi dengan air membentuk hidroksida logam alkali dengan melepas gas hidrogen, dapat membentuk oksida, peroksida beahkan superoksida yang ketiganya menghilangkan bentuk kilapan logamnya.
Logam alkali tanah juga cukup reaktif namun tidak sereaktif jika dibandingkan dengan logam alkali. Memiliki kecenderungan melepas kedua elektron terluarnya membentuk ion M2+ dengan bentuk konfigurasinya menyerupai konfigurasi gas mulia yang stabil dan karakter ini meningkat dari berilium sampai barium dan khusus untuk berilium di alam lebih cenderug berbentuk molekul dibanding berbentuk ionik terutama oksidanya terbentuk oksida amfoter bukan oksida logam yang bersifat basa.
Semua unsur IIA tidak bereaksi dengan air kecuali pada suhu tinggi, namun berilium dan magnesium berkorosi terus menerus dalam udara sampai mereka seluruhnya telah diubah menjadi oksida, hidroksida atau karbonat. Berilium dan magnesium mudah bereaksi dengan oksigen tetapi selaput oksida yang kuat yang terbentuk cenderung melindungi logam yang terletak disebelah bawahnya dari serangan lebih lanjut pada suhu kamar. Bila dipanaskan keras-keras bahkan kedua logam ini pun akan terbakar dengan baik. Pada suhu tinggi magnesium yang terbakar di udara bereaksi bukan hanya dengan oksigen tetapi bahkan dengan nitrogen dan karbon dioksida.
Warna nyala yang dihasilkan oleh suatu unsur disebut spektrum emisi. Spektrum emisi yang dihasilkan berkaitana dengan model atom Niels Bohr. Ketika atom diberikan sejumlah energi, elektron-elektron yang berada dalam dasar akan tereksitasi menuju kulit yang lebih tinggi dengan tingkat energi yang lebih tinggi. Elektron yang tereksitasi dapat kembali pada keadaan dasar atau mengisi dengan memancarkan sejumah enegi dalam bentuk radiasi elektromagnetik dengan panjang gelombang (λ) tertentu.
C. Halogen
Halogen adalah kelompok unsur kimia yag berada pada golongan VIIA pada tabel periodik. Kelompok ini terdiri dari flourin (F), klorin (Cl), brom (Br), iodin (I), dan astatin (At). Dari kelima unsur halogen, hanya astatin yang langka dialam karena bersifat radioaktif. Adapun unsur halogen yang lain terdapat dalam bentuk senyawa garamnya karena sangat reaktif. Halogen merupakan unsur-unsur yang menghasilkan garam jika bereaksi dengan logam. Istilah ini berasal dari istilah ilmiah Perancis dari abad ke-18 yang diadaptasi dari bahasa Yunani. Halogen juga merupakan golongan dengan kereaktifan tertinggi. Jadi halogen juga merupakan golongan paling non-logam.
Unsur-unsur halogen secara alamiah berbentuk diatomik (X2). Mereka membutuhkan satu tambahan elektron untuk mengisi orbit elektron terluarnya, sehingga cenderung membentuk ion negatif bermuatan satu. Ion negatif ini disebut ion halida, dan garam yang terbentuk oleh ion ini disebut garam halida. Unsur halogen tidak pernah ditemukan dalam keadaan bebas dialam karena sangat reaktif sehingga hanya dapat ditemukan dalam bentuk garam-garamnya. Kestabilan molekul halogen berkurang dari atas ke bawah. Hal ini berkaitan dengan makin besarnya jari-jari atom sehingga energi ikatannya makin kecil. Namun terjadi pengecualian untuk F2 yang memiliki jari-jari atom kecil. Energi ikatan F2 kecil sehingga sangat reaktif, bahkan merupakan unsur yang paling reaktif, ikatan F-F cenderung putus.
Pada suhu kamar, flourin dan klorin berada pada fase gas. bromin dalam bentuk cair yang mudah menguap, dan iodin dalam bentuk padat yang mudah menyublim. Jika dipanaskan iodin tidak berubah menjadi cair, tapi berubah menjadi gas. Halogen memiliki warna dan bau yang khas. Misalnya flourin berwarna kuning muda, klorin berwarna hijau muda, bromin berwarna merah tua, iodin padat berwarna hitam, dan uap iodin berwarna ungu. Adapun bau halogen adalah bau merangsang yang menusuk.
Kelarutan halogen dalam ari berkurang seiring dengan penambahan massa atom. Flourin tidak hanya larut dalam air, tetapi dapat bereaksi membentuk molekul HF. Dengan kata lain dalam larutan berair, flourin dijumpai dalam bentuk asamnya. yaitu HF bukan F2. Klorin dan bromin sedikit bereaksi dengan air pada saat pelarutan. Adapun iodin tidak reaktif. dengan air. Itulah sebabnya molekul bersifat nonpolar dan sukar larut dalam air. Namun iodin menjadi mudah larut dalam larutan yang mengandung ion iodida (I-). Hal ini disebabkan iodin dalam larutan yang mengandung ionnya dapat membentuk poliiodida (I3-). Ion poliiodida (I3-) mudah terurai kembali menjadi I2 sehingga larutan yang mengandung ion itu sama dengan larutan I2 (Svehla, 1985).
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum golongan dan identifikasi unsur ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum golongan dan identifikasi unsur ini, sebagai berikut:
Alat
- tabung reaksi
- rak tabung reaksi
- gelas ukur
- pipet tetes
- pembakar bunsen
Bahan
- kawat nikrom
- BaCl2
- CaCl2
- LiCl
- KCl
- NaCl
- SrCl2
- HCl pekat
- NaBr
- NaI
- CCl4
- air klorin
- HNO3 encer
- larutan anu (x)
- larutan anu (y)
- (NH4)2CO3
- (NH4)3PO4
- (NH4)2SO4
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum golongan dan identifikasi unsur :
a. Uji nyala untuk unsur alkali dan alkali tanah
- Letakkan enam tabung reaksi pada rak. Tambahkan kedalam masing-masing 2ml larutan BaCl2 0,5M; CaCl2 0,5M; LiCl 0,5M; KCl 0,5M; NaCl 0,5M; SrCl2 0,5M.
- Ambil kawat nikrom, panaskan pada bagian biru dari nyala bunsen. Panaskan terus sampai tidak ada lagi warna yang timbul pada nyala bunsen. Panaskan terus sampai tidak ada lagi warna yang timbul pada nyala. Untuk mencegah kontaminasi, jangan menyentuh kawat nikrom bersih.
- Celupkan kawat tadi ke dalam tabung yang berisi larutan barium, lalu panaskan ujung kawat pada nyala. Catat hasil pengamatan.
- Bersihkan kawat dan ulangi pada larutan alkali yag lain. (Untuk membersihkan kawat bebas pakai, celupkan kawat ke dalam larutan HCl pekat 12M dan panaskan sampai merah).
b. Reaksi-reaksi unsur alkali dan alkali tanah
- Masukkan 2ml larutan barium, kalsium, litium, kalium natrium, dan stronsium ke dalam masing-masing tabung reaksi
- Tambahkan 1 ml larutan (NH4)2CO3 0,5M ke dalam setiap tabung. Amati apakah terbentuk endapan.
- Bersihkan tabung reaksi dan bilas dengan air suling, ulangi kegiatan 1.
- Tambahkan 1 ml larutan (NH4)3PO4 0,5M ke dalam setiap tabung. Amati apakah terbentuk endapan.
- Bersihkan tabung reaksi dan bilas dengan air suling, ulangi kegiatan 1.
- Tambahkan 1 ml larutan (NH4)2SO4 0,5M ke dalam setiap tabung. Amati apakah terbentuk endapan.
c. Reaksi-reaksi halida
- Masukkan 1 ml larutan NaCl 0,5M; NaBr 0,5M; NaI 0,5M ke dalam masing-masing tabung reaksi
- Tambahkan 1ml CCl4 pada setiap 1ml air klorin, dan 5 tetes HNO3 6M encer ke dalam setiap tabung reaksi
- Kocok setiap tabung dan amati warna lapisan CCl4 di bagian bawah
d. Analisis larutan anu
- Mintalah sejumlah larutan anu (x) kepada asisten. Lakukan uji nyala dan catat pengamatan
- Masukkan 1 ml larutan anu masing-masing ke dalam tiga tabung reaksi. Tambahkan 1ml (NH4)2CO3 ke dalam tabung pertama, 1 ml (NH4)3PO4 ke dalam tabung kedua, dan 1ml (NH4)2SO4 ke dalam tabung ketiga, catat pengamatan
- Masukkan 1ml larutan anu (y) ke dalam tabung reaksi. Tambahkan 1ml CCl4, 1ml air klorin, dan setetes HNO3, kocok tabung dan catat warna lapisan CCl4
- Bandingkan uji nyala dan reaksi larutan x dengan keenam larutan yang diketahui prosedur A dan B. Nyatakan unsur alkali apa yang terdapat dalam larutan x
- Bandingkan uji halida dari larutan y dengan ketiga larutan halida yang diketahui (prosedur C). Nyatakan halida apa saja yang ada dalam larutan y.
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
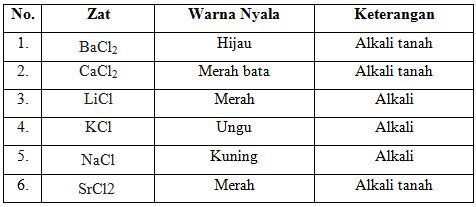
a. Uji nyala untuk unsur alkali dan alkali tanah
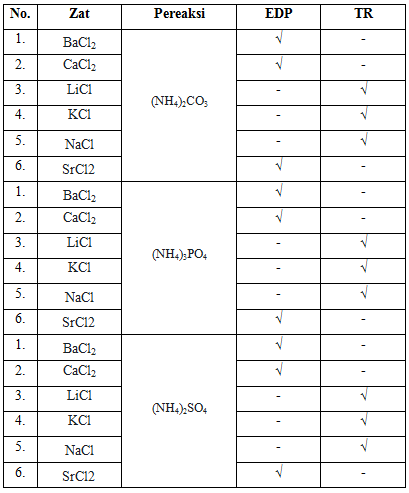
b. Reaksi-reaksi unsur alkali dan alkali tanah
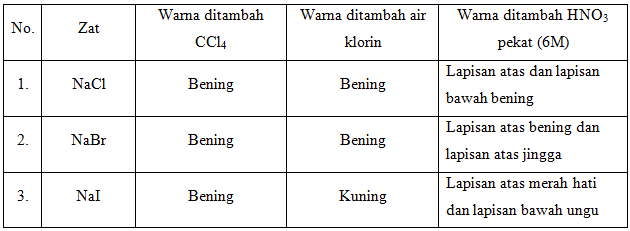
c. Reaksi-reaksi halida
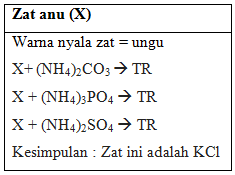
d. Analisis larutan anu
B. Pembahasan
Adapun pembahasan dalam laporan golongan dan identifikasi unsur ini adalah sebagai berikut :
Pada praktikum kimia dasar kali ini kami melakukan percobaan mengenai golongan dan identifikasi unsur. Unsur adalah satuan terkecil dari partikel ion atau molekul dimana tidak dapat lagi diuraikan menjadi partikel yang lebih sederhana oleh reaksi kimia biasa. Deretan unsur tabel priodik unsur berupa kolom-kolom kecil (disebut juga dengan deret tegak) dibedakan sebagai golongan utama (golongan A) dan golongan transisi (golongan B). umumnya sifat unsur segolongannya baik sifat fisik maupun kimianya mirip satu sama lain kecuali untuk golongan transisi (golongan B), kesamaan sifat ini harus jelas. Untuk mengidentifikasi unsur dan golongan, dapat dilakukan dengan uji nyala dan pereaksian dengan zat kimia. Maka, terdapat 4 uji yang kami lakukan pada praktikum kali ini yakni, uji nyala untuk unsur alkali dan alkali tanah, reaksi-reaksi unsur alkali dan alkali tanah, reaksi-reaksi halida, dan analisis larutan anu.
a. Uji nyala untuk unsur alkali dan alkali tanah
Dalam percobaan pertama dilakukan uji nyala alkali dan alkali tanah. Untuk mengetahui warna nyala dari unsur-unsur alkali dan alkali tanah yang terbilang reaktif, maka dapat dilakukan dengan mengeksitasi unsur-unsur tersebut, dengan cara membakar senyawa-senyawanya.
Senyawa-senyawa dari unsur alkali dan alkali tanah yang digunakan adalah BaCl2 0,5M; CaCl2 0,5M; LiCl 0,5M; KCl 0,5M; NaCl 0,5M; dan SrCl2 0,5M. Pada masing-masing sampel dicelupkan kawat nikrom yang telah dibersihkan dengan HCl. Penggunakan HCl bertujuan untuk membersihkan zat-zat pengotor atau kontaminan yang masih melekat pada kawat nikrom sehingga kontaminan tersebut akan menguap dari kawat. Indikator kawat nikrom ini bersih adalah nyala api sama dengan semula yakni pada nyala api biru tetaplah biru. Setelah dilakukan uji nyala logam-logam alkali dan alkali tanah ini menghasilkan warna-warna tertentu yang spesifik. Ketika suatu senyawa dipanaskan, maka akan terurai menghasilkan unsur-unsur penyusunnya dalam wujud gas atau uap. Kemudian atom-atom dari unsur logam alkali dan alkali tanah tersebut mampu menyerap sejumlah energi tinggi (keadaan tereksitasi). Pada keadaan energi tinggi, atom logam tersebut sifatnya tidak stabil sehingga mudah kembali ke keadaan semula (berenergi rendah) dengan cara memancarkan energi yang diserapnya dalam bentuk cahaya. Besarnya energi yang diserap atau dipancarkan oleh setiap unsur logam alkali dan alkali tanah bersifat khas.
Hasil yang didapat dari masing-masing uji nyala logam alkali dan alkali tanah yakni, pada BaCl2 memberikan warna hijau, CaCl2 memberikan warna merah bata, LiCl memberikan warna merah, KCl memberikan warna ungu, NaCl memberikan warna kuning dan SrCl2 memberikan warna merah. Warna yang dihasilkan pada uji nyala ini sesuai dengan warna nyala yang terdapat pada teori.
b. Reaksi-reaksi unsur alkali dan alkali tanah
Pada percobaan kedua mengenai reaksi unsur alkali dan alkali tanah. Penggunaan unsur alkali dan alkali tanah masih sama seperti percobaan pertama yakni BaCl2 0,5M; CaCl2 0,5M; LiCl 0,5M; KCl 0,5M; NaCl 0,5M; dan SrCl2 0,5M yang masing-masing sebanyak 2ml di masukkan kedalam tabung reaksi. Larutan pereaksi yang digunakan adalah (NH4)2CO3, (NH4)3PO4, dan (NH4)2SO4 yang dicobakan satu-persatu untu melihat ada atau tidaknya endapan. Pada umumnya ketika pereaksi in direaksikan dengan alkali tanah maka akan terbentuk endapan. Hal ini karena, hasil kali kelarutan ion alkali tanah > ion alkali. Sedangkan pada unsur alkali tidak terjadi endapan pada ketiga pereaksi tersebut.
Setelah dilakukan percobaan, dengan masing-masing pereaksi maka didapat pada pereaksi (NH4)2CO3 membentuk endapan dengan senyawa BaCl2, CaCl2, dan SrCl2. Sedangkan dengan unsur LiCl, KCl, dan NaCl tidak membetuk endapan. Reaksi yang terjadi adalah :
BaCl2 + (NH4)2CO3 –> BaCO3 + 2NH4Cl (mengendap)
CaCl2 + (NH4)2CO3 –> CaCO3 + 2NH4Cl (mengendap)
LiCl + (NH4)2CO3 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
KCl + (NH4)2CO3 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
NaCl + (NH4)2CO3 à TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
SrCl2 + (NH4)2CO3 à SrCO3 + 2NH4Cl (mengendap)
Pada pereaksi (NH4)3PO4 menghasilkan endapan dengan senyawa BaCl2, CaCl2, dan SrCl2. Sedangan pada senyawa LiCl, KCl, dan NaCl tidak membentuk endapan. Reaksi yang terjadi adalah :
3BaCl2 + 2(NH4)3PO4 –> Ba3(PO4)2 + 6NH4Cl (mengendap)
3CaCl2 + 2(NH4)3PO4 –> Ca3(PO4)2 + 6NH4Cl (mengendap)
LiCl + (NH4)3PO4 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
KCl + (NH4)3PO4 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
NaCl + (NH4)3PO4 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
3SrCl2 + 2(NH4)3PO4 –> Sr3(PO4)2 + 6NH4Cl (mengendap)
Pada pereaksi terakhir yakni (NH4)2SO4 hasil yang didapat adalah sama yakni pada senyawaan alkali tanah yaitu BaCl2, CaCl2, dan SrCl2 mengalami pengendapan. Dan pada senyawa alkali yaitu LiCl, KCl, dan NaCl tidak membentuk endapan. Reaksi yang terjadi adalah :
BaCl2 + (NH4)2SO4 –> BaSO4 + 2NH4Cl (mengendap)
CaCl2 + (NH4)2SO4 –> CaSO4 + 2NH4Cl (mengendap)
LiCl + (NH4)2SO4 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
KCl + (NH4)2SO4 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
NaCl + (NH4)2SO4 –> TR (Tidak mengalami pengendapan atau tidak terjadi reaksi)
SrCl2 + (NH4)2SO4 –> SrSO4 + 2NH4Cl (mengendap)
c. Reaksi-reaksi halida
Pada percobaan ketiga mengenai reaksi halida. Halida adalah senyawa biner, dimana salah satu bagiannya adalah salah satu atom halogen dan bagian lainnya adalah elemen lainnya atau radikal yang mempunyai tingkat keelektronegatifan lebih kecil daripada atom halogen, untuk membentuk senyawa fluorida, klorida, bromida, iodida, atau astatin. Kebanyakan garam merupakan halida. Semua logam pada elemen grup 1 akan membentuk halida yang berbentuk padatan putih dalam suhu ruangan. Garam halida dapat terbentuk dari interaksi langsung antara logam dengan halogen. Halida yang digunakan pada percobaa ini adalah NaCl, NaBr, dan NaI.
Percobaan dilakukan dengan mereaksikan masing-masing halida dengan penambahan 1ml CCl4, kemudian ditambahkan 1ml air klorin dan yang terakhir ditambahkan 5 tetes HNO3. Pada NaCl tidak terjadi perubahan warna baik lapisan atas maupun lapisan bawah tetap bening. Pada NaBr lapisan atas bening, sedangkan lapisan bawah berwarna jingga. Pada NaI lapisan atas Lapisan atas merah hati dan lapisan bawah berwarna ungu.
d. Analisis larutan anu
Pada percobaan terakhir kami menganalisis dua larutan yang belum diketahui, yakni larutan X dan Y. Pada larutan anu (X) ketika dilakuakn uji nyala warna yag dihasilkan adalah warna ungu, maka larutan ini kami indikasikan adalah dari golongan alkali yakni kalium (K). Kemudian larutan anu (X) ini kami reaksikan dengan masing-masing pereaksi (NH4)2CO3, (NH4)3PO4, dan (NH4)2SO4 . Ketika direaksikan tidak terjadi endapan. Maka dapat kami nyatakan bahwa larutan anu (X) adalah logam kalium, dengan senyawanya adalah KCl.
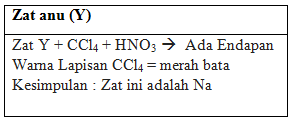
Pada larutan anu (Y), kami lakukan uji dengan menambahkan CCl4, air klorin dan HNO3. Pada saat pereaksian terdapat endapan, dan warna lapisan menjadi merahbata. Maka kami menyatakan larutan anu (Y) adalah Na, tepatnya senyawa NaI.
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum golongan dan identifikasi unsur dapat disimpulkan bahwa :
- Pada Tabel Periodik, tiap unsur terletak pada golongan dan periode tertentu, golongan merupakan kolom yang berisi unsur-unsur yang mempunyai kesamaan sifat. Pada logam alkali cenderung lebih reaktif jika dibadingkan dengan alkali tanah.
- Uji nyala untuk unsur golongan alkali dan alkali tanah. Warna nyala unsur-unsur golongan alkali (IA) yaitu : Li (merah), Na (kuning), dan K (Ungu). Warna nyala unsur golongan alkali tanah (IIA) yaitu : Ca (merah bata), Sr (merah), dan Ba (hijau).
- Air klorin bereaksi dengan ion Br– dan I– dengan membentuk endapan, pada Br– terbentuk lapisan atas berwarna jingga pada lapisan bawah berning, pada I‑ terbentuk endapan berwarna ungu kemerahan pada lapisan atas. Sedangkan air klorin tidak bereaksi dengan ion Cl– sehingga pada uji coba hanya terbentuk lapisan berwarna bening.
- Zat X yang teridentifikasi oleh praktikan dari hasil percobaan adalah KCl dan zat Y adalah NaI.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Rahardjo P. 2012. Panduan Budidaya dan Pengolahan Kopi Arabika dan Robusta. Jakarta : Penerbar Swadaya
- Svehla, G. 1985. Vogel Bagian I, Buku Teks Analisis Anorganik. Jakarta: Liberty.
Download Laporan Praktikum [PDF]
Anda dapat mendownload Laporan Praktikum Golongan dan Identifikasi Unsur ini dalam format PDF dengan mengklik tombol download yang sudah kami sediakan di bawah.

