Download Laporan Praktikum Uji Protein dan landasan teori mengenai Uji Protein lengkap dengan pembahasan dalam format PDF. Laporan Praktikum ini merupakan kelanjutan dari Laporan Praktikum biologi yang pernah admin bahas minggu lalu, laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
BAB I PENDAHULUAN
Tujuan :
Adapun tujuan dalam praktikum uji protein adalah sebagai berikut :
- Mengetahui faktor yang mempengaruhi denaturasi protein
- Mengetahui faktor yang mempengaruhi pengendapan protein
- Mengetahui ikatan peptida pada protein
- Mengetahui adanya kandungan asam amino
- Mengetahui gugus benzen pada protein
A. Latar Belakang
Salah satu kandungan gizi yang biasa terdapat dalam makanan adalah protein. Ketika mengkonsumsi makanan yang mengandung protein, maka sistem pencernaan akan memecah menjadi asam amino yang dibutuhkan untuk berbagai organ termasuk otot, tulang dan darah. Protein merupakan komponen yang penting dalam tubuh kita, senyawa organik ini berfungsi sebagai katalis reaksi biokimia (enzim), pengangkutan oksigen (pada hemoglobin), protein cadangan dan sebagainya.
Penyusun protein adalah asam amino yang berikatan satu sama lain melalui ikatan peptida. Protein dapat mengalami denaturasi oleh panas, pH, logam berat dan sebagainya. Beberapa pengujian terhadap bahan makanan dapat mengetahui kandungan protein didalamnya, dengan reaksi perubahan warna.
BAB II KAJIAN PUSTAKA
Asam Amino
Asam amino adalah asam karboksilat yang terdiri atas atom karbon yang terikat pada satu gugus karboksil (-COOH), satu gugus amino (-NH2), satu gugus hidrogen (- H) dan satu gugus radikal (-R) atau rantai cabang (Almatsier, 2004). Struktur asam amino :
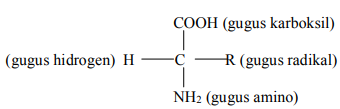
Pada umumnya asam amino larut dalam air dan tidak larut dalam pelarut organik non polar seperti eter, aseton, dan kloroform. Sifat asam amino ini berbeda dengan asam karboksilat maupun dengan sifat amina. Asam karboksilat alifatik maupun aromatik yang terdiri atas beberapa atom karbon umumnya kurang larut dalam air tetapi larut dalam pelarut organik. Demikian amina pula umumnya tidak larut dalam air, tetapi larut dalam pelarut organik (Poejiadi. A, 1994).
Pengertian Protein
Protein merupakan makromolekul yang terbentuk dari asam amino yang tersusun dari atom nitrogen, karbon, dan oksigen, beberapa jenis asam amino yang mengandun sulfur (metionin, sistin, dan sistein) yang dihubungkan oleh ikatan peptida. Dalam makhluk hidup, protein berperan sebagai pembentuk struktur sel dan beberapa jenis protein memiliki peran fisiologis (Bintang, 2010).
Menurut Suhardjo dan Clara (1992), protein merupakan zat gizi yang sangat penting, karena yang paling erat hubungannya dengan proses-proses kehidupan. Nama protein berasal dari bahasa Yunani (Greek) proteus yang berarti “yang pertama” atau “yang terpenting”. Seorang ahli kimia Belanda yang bernama Mulder, mengisolasi susunan tubuh yang mengandung nitrogen dan menamakannya protein, terdiri dari satuan dasarnya yaitu asam amino (biasa disebut juga unit pembangun protein).
Protein merupakan salah satu kelompok bahan makronutrien. Tidak seperti bahan makronutrien lainnya (karbohidrat, lemak), protein ini berperan lebih penting dalam pembentukan biomolekul daripada sumber energi. Namun demikian apabila organisme sedang kekurangan energi, maka protein ini dapat juga di pakai sebagai sumber energi. Keistimewaan lain dari protein adalah strukturnya yang selain mengandung N, C, H, O, kadang mengandung S, P, dan Fe (Sudarmadji, 1989)
Klasifikasi Protein Berdasarkan Bentuk
a. Protein fibriler/ Skleroprotein
Protein ini berbentuk serabut, tidak larut dalam pelarut-pelarut encer, baik larutan garam, asam, basa, ataupun alkohol. Berat molekulnya yang besar belum dapat ditentukan dengan pasti dan sukar dimurnikan. Susunan molekulnya terdiri dari rantai molekul yang panjang sejajar dengan rantai utama, tidak membentuk kristal dan bila rantai ditarik memanjang, dapat kembali pada keadaan semula. Kegunaan protein ini terutama hanya untuk membentuk struktur bahan dan jaringan. Contoh protein fibriler adalah kolagen yang terdapat pada tulang rawan, miosin pada otot, keratin pada rambut, dan fibrin pada gumpalan darah (Winarno, 2004).
b. Protein globular/ sferoprotein
Protein ini berbentuk bola, banyak terdapat pada bahan pangan seperti susu, telur, dan daging. Protein ini larut dalam larutan garam dan asam encer, juga lebih mudah berubah dibawah pengaruh suhu, konsentrasi garam, pelarut asam, dan basa jika dibandingkan dengan protein fibriler. Protein ini mudah terdenaurasi, yaitu susunan molekulnya berubah yang diikuti dengan perubahan sifat fisik dan fisiologiknya seperti yang dialami oleh enzim dan hormon (Winarno, 2004).
Struktur Protein
a. Struktur primer
Struktur primer adalah struktur dasar dari protein. Susunan linier asam amino dalam protein yang merupakan suatu rangkaian unik dari asam amino yang menentukan sifat dasar dari berbagai protein, dan secara umum menentukan bentuk struktur sekunder dan tersier (Martoharsono, 1998).
b. Struktur sekunder
Struktur sekunder adalah rantai polipeptida yang berlipat-lipat dan merupakan bentuk tiga dimensi dengan cabang-cabang rantai polipeptidanya tersusun saling berdekatan. Protein terbentuk oleh adanya ikatan hidrogen antar asam amino dalam rantai sehingga strukturnya tidak lurus, melainkan bentuk zig zag dengan gugus R mencuat keatas dan kebawah. Contoh struktur ini adalah bentuk α-heliks pada wol, serta bentuk heliks pada kolagen (Martoharsono, 1998).
c. Struktur tersier
Struktur tersier adalah susunan dari struktur sekunder yang satu dengan struktur sekunder yang lain. Biasanya bentuk-bentuk sekunder ini dihubungkan oleh ikatan hidrogen, ikatan garam, ikatan hidrofobik, dan ikatan disulfida. Ikatan disulfida merupakan ikatan yang terkuat dalam mempertahankan struktur tersier protein (Gaman, 1992).
Fungsi Protein
a. Sebagai enzim
Berperan terhadap perubahan-perubahan kimia dalam sistem biologis.
b. Alat pengangkut dan alat penyimpan
Banyak model molekul dengan BM kecil serta beberapa ion dapat diangkut atau dipindahkan oleh protein-protein tertentu.
c. Pengaturan pergerakan
Protein merupakan komponen utama daging, gerakan otot terjadi karena adanya dua molekul protein yang saling bergeseran.
d. Penunjang mekanis
Kekuatan dan daya tahan robek kulit dan tulang disebabkan adanya kolagen, suatu protein yang berbentuk bulat panjang dan mudah membentuk serabut.
e. Pertahanan tubuh
Pertahanan tubuh biasanya dalam bentuk antibodi, yaitu suatu protein khusus yang dapat mengenal dan menempel atau mengikat benda-benda asing yang masuk kedalam tubuh seperti virus, bakteri, dan sel-sel asing lainnya.
f. Media perambatan implus syaraf
Protein yang mempunyai fungsi ini biasanya berbentuk reseptor, misalnya rodopsin, suatu protein yang bertindak sebagai reseptor/ penerima warna atau cahaya pada sel-sel mata.
g. Pengendalian pertumbuhan
Protein ini bekerja sebagai reseptor (dalam bakteri) yang dapat mempengaruhi fungsi bagian-bagian DNA yang mengatur sifat dan karakter bahan (Winarno, 2004).
Analisis Protein Secara Kualitatif
a. Reaksi biuret
Reaksi ini merupakan tes umum yang baik terhadap protein, dilakukan dengan cara menambahkan larutan protein dengan beberapa tetes CuSO4 encer dan beberapa ml NaOH. Reaksi positif dengan warna ungu, terjadi karena adanya kompleks senyawa yang terjadi antara Cu dengan N dari molekul ikatan peptida.
b. Reaksi ninhidrin
Larutan protein ditambah dengan beberapa tetes larutan ninhidrin kemudian dipanaskan beberapa saat dan didiamkan hingga dingin, hasil positif apabila terbentuk warna biru (Kusnawidjaja, 1989).
c. Reaksi Molish
Reaksi positif menunjukkan adanya gugus karbohidrat pada protein. Tes ini dilakukan dengan cara, larutan protein ditambahkan dengan beberapa tetes alpha naftol, dikocok perlahan selama 5 detik, miringkan tabung dan ditambahkan H2SO4 melalui dinding tabung, kemudia tegakkan kembali tabung. Hasil positif bila terlihat adanya cincin diperbatasan kedua cairan.
d. Reaksi Millon
Dilakukan dengan cara menambahkan larutan protein dengan beberapa tetes reagen millon diaduk sampai adanya endapan putih kemudian dipanaskan hati-hati dan ditambahkan NaNO3 setelah dingin. Hasil positif ditandai dengan terjadinya warna merah pada larutan tersebut.
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum uji protein ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam Praktikum Uji Protein ini, sebagai berikut:
Alat
- tabung reaksi
- rak tabung reaksi
- gelas ukur
- pipet tetes
- penangas air
- erlenmeyer
Bahan
- larutan sampel (albumin, susu, ekstrak tempe)
- HCl 1 N
- NaOH 1 N
- aquades
- ZnSO4
- NaOH 10%
- CuSO4 0,1%
- ninhidrin 0,1%
- HNO3 pekat
- NaOH 40%
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam Praktikum Uji Protein :
a. Denaturasi oleh panas dan pH ekstrem
- Ambil 3 tabung reaksi, masukkan masing-masing tabung dengan 5 ml sampel albumin
- Tambahkan 0,5 ml HCl 1N pada tabung pertama, 0,5 ml NaOH 1N pada tabung ke-2, 0,5 ml buffer asetat pada tabung ke-3
- Panaskan dengan penangas air selama 15 menit
- Dinginkan tabung , tambahkan 5 ml buffer asetat pada tabung pertama dan ke-dua
b. Prespitasi dengan menggunakan logam berat
- Masukkan 2 ml larutan sampel kedalam tabung reaksi
- Tambahkan setetes demi setetes larutan ZnSO4 encer , catat perubahan yang terjadi
- Tambahkan pereaksi tersebut hingga berlebih, endapan yang mula-mula terjadi akan larut kembali
c. Uji biuret
- Masukkan 2 ml larutan sampel ke dalam tabung reaksi
- Tambahkan 1 ml NaOH 10 %, kemudian homogenkan
- Tambahkan 3 tetes larutan CuSO4
- Homogenkan larutan dan amati warna yang terbentuk
d. Uji ninhdrin
- Masukkan 2 ml larutan sampel ke dalam tabung reaksi
- Tambahkan 10 tetes larutan ninhidrin 0,1%
- Panaskan dengan penangas air hingga mendidih,
- Tunggu hingga dingin, amati perubahan warna yang terjadi
e. Uji Xantoprotein
- Masukkan 2ml larutan sampel kedalam tabung reaksi
- Tambahkan 1ml HNO3 pekat
- Panaskan dengan penangas air selama 15 menit
- Dinginkan, kemudian tambahkan NaOH 40%, amati perubahan warna
BAB IV HASIL DAN PEMBAHASAN
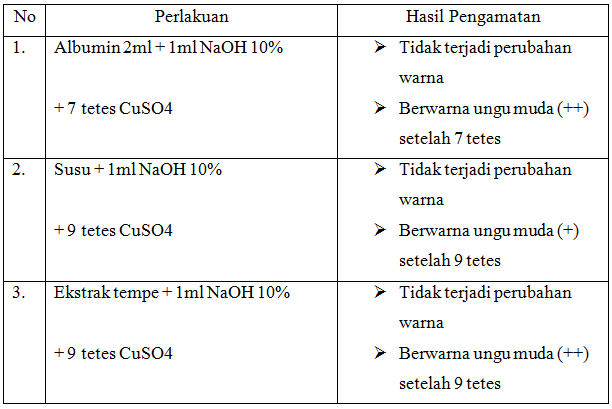
A. Hasil Percobaan




B. Pembahasan
Adapun pembahasan dalam laporan biokimia ini adalah sebagai berikut :
Pada praktikum uji protein kali ini kami melakukan 5 uji yakni : denaturasi oleh panas dan pH ekstrem, prespitasi dengan menggunakan logam berat, uji biuret, uji ninhidrin, dan xantoprotein. Menurut Muchtadi (2010), protein merupakan zat makanan yang mengandung nitrogen yang diyakini sebagai faktor penting untuk fungsi tubuh, sehingga tidak mungkin ada kehidupan tanpa protein. Selain itu Gandy (2014) mengatakan bahwa, protein merupakan makromolekul yang terdiri dari rantai asam amino yang dihubungkan oleh ikatan peptida membentuk rantai peptida dengan berbagai panjang dari dua asam amino (dipeptida), 4-10 peptida (oligopeptida), dan lebih dari 10 asam amino (polipeptida).
a. Denaturasi oleh panas dan pH ekstrem
Pada percobaan pertama kami melakukan uji denaturasi pada protein. Denaturasi merupakan suatu proses dimana terjadinya perubahan terhadap konformasi protein. Denaturasi meliputi kerusakan yang terjadi pada struktur sekunder dan tersier protein. Denaturasi protein dapat disebabkan oleh suhu atau pH yang terlalu ekstrem.
Sampel yang digunakan adalah albumin saja untuk membandingkan hasil dari tiga perlakuan. Pada tabung pertama ditambahkan 0,5 ml HCl, tabung ke-2 ditambahkan 0,5 ml NaOH, dan tabung ke-3 ditambahkan 0,5 ml buffer asetat, kemudan dipanaskan. Pada tabung pertama setelah penambahan HCl tidak terjadi perubahan yang kentara. Kemudian setelah dipanaskan campuran menjadi sedkit keruh. Penambahan HCl yang bersifat asam kuat menyebabkan pH protein menjadi sangat asam. Setelah didinginkan dan ditambahkan buffer asetat pH 4,7 campuran menjadi keruh. Pada tabung ke-2 setelah penambahan NaOH dan dilakukan pemanasan campuran menjadi keruh, pH protein menjadi basa. Kemudian tabung didinginkan dan ditambahkan buffer asetat pH 4,7 dan terbentuk endapan putih dan larutan menjadi keruh.
Pada tabung ke-3 setelah ditambahakn buffer asetat dan dilakukan pemanasan terbentuk endapan putih. Endapan putih mengindikasikan terjadinya denaturasi. Hal ini terjadi karena buffer asetat sangat kuat mempertahankan pH sehingga merusak keseimbangan zwitter ion ke kondisi asam dibawah titik isoelektrik. Perubahan struktur yang diakibatkan proses denaturasi adalah perubahan konfigurasi α-heliks menjadi memanjang. Hal ini disebabkan karena rusaknya ikatan hidrogen dan ikatan nonpolar yang terjadi pada struktur berlipat dari protein. Reaksi denaturasi protein :
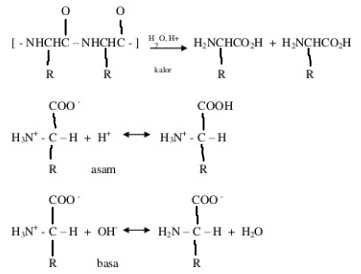
b. Prespitasi dengan menggunakan logam berat
Pada percobaan presptasi menggunakan logam berat, kami menggunakan tiga sampel yakni, albumin, susu, dan ekstrak tempe. Pada masing-masing sampel diberi tetes demi tetes ZnSO4, setelah diamati terbentuk endapan putih pada campuran. Hal ini membuktikan bahwa protein larut dengan penambahan logam berat (Zn), yang sesuai dengan prinsip kerja pengujian pengendapan dengan logam berat. Kemudian di tambahkan ZnSO4 kembali hingga berlebih. Dan yang terjadi adalah endapan yang terjadi larut kembali.
Sejalan dengan percobaan menurut Triyono (2010) bahwa, faktor yang mempengaruhi terjadinya endapan protein oleh logam berat adalah pada titik isoelektriknya, protein akan berikatan antara muatannya sendiri membentuk lipatan ke dalam sehingga terjadi pengendapan yang relatif cepat, sedangkan saat telah lewat titik isoelektriknya, protein akan kembali ke kondisi semula.
c. Uji biuret
Pada percobaan ketiga kami melakukan uji biuret. Uji ini dilakukan untuk menunjukkan adanya ikatan peptida dalam suatu zat yang akan diuji, dalam hal ini kam menggunakan albumin, susu dan ekstrak tempe. Reaksi biuret merupakan reaksi warna yang umum untuk gugus peptida (-CO-NH-) dan protein.
Uji dilakukan dengan menambahkan 1 ml NaOH ke dalam sampel, kemudan diberikan beberapa tetes CuSO4. Fungsi pereaksi NaOH dan CuSO4 adalah untuk membuat suasana larutan menjadi basa dan untuk menghasilkan senyawa kompleks berwarna ungu. Hasil yang didapatkan adalah setiap sampel berwarna ungu muda. Terbentuknya warna ungu pada sampel albumin, susu dan ekstraks tempe karena terbentuknya senyawa kompleks anatar Cu2+ dan N dari molekul ikatan peptida yaitu gugus peptida (-CO-NH-). Makin banyak atau makin penjang ikatan peptida dalam protein maka warna ungu akan makin kuat intensitasnya. Banyaknya asam amino yang terikat pada ikatan peptida mempengaruhi warna reaksi ini. Senyawa dengan dipeptida akan memberi warna biru, tripeptida ungu, dan tetrapeptida serta peptida kompleks akan memberikan warna merah. Reaksi yang terjadi pada percobaan ini adalah :
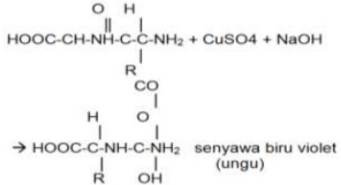
d. Uji ninhidrin
Uji ninhidrin merupakan uji yang umum digunakan untuk protein yang spesifik untuk asam amino. Pada percobaan ini sampel yang digunakan adalah albumin, susu, dan ekstrak tempe. Sampel kemudian diberikan 10 tetes larutan ninhidrin dan kemudian dilakukan pemanasan. Fungsi dari larutan ninhidrin adalah sebagai oksidator yang menyebabkan dekarboksilasi oksidatif dari asam amino yang menghasilkan CO2, NH3, dan aldehid yang rantainya lebih pendek 1 C dari asam amino asalnya. Ninhidrin yang tereduksi akan bereaksi dengan NH3 sehingga membentuk senyawa kompleks yang berwarna biru keunguan, dengan absorbsi warna maksimum pada panjang gelombang 570 nm.
Fungsi pemanasan adalah untuk membuat protein mengalami denaturasi, sehingga diharapkan molekul protein yang terdiri dari banyak polipeptida dapat terputus menjadi molekul-molekul penyusunnya yang lebih kecil, sehingga dapat mempercepat reaksi. Hasil yang didapat pada setiap sampel adalah menghasilkan warna ungu, yang berarti bahwa bahwa asam amino pada sampel bereaksi positif terhadap uji ninhidrin. Reaksi yang terjadi adalah :
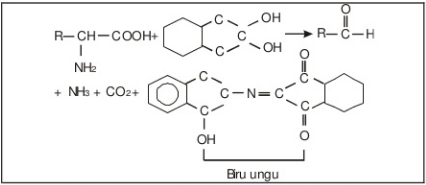
e. Uji xantoprotein
Pada percobaan terakhir kami melakukan uji xantoprotein. Uji ini merupakan uji yang digunakan untuk menunjukkan keberadaan gugus benzen. Kami menggunakan 3 sampel yaitu albumin, susu, dan ekstrak tempe. Sampel ditambahkan 1 ml HNO3 pekat. Asam nitrat (HNO3) merupakan larutan asam kuat yang mempunyai pKa sebesar -2. Dalam termperatur ruangan, asam nitrat berbentuk uap berwarna merah atau kuning. Larutan asam nitrat pekat ini ditambahkan bertujuan untuk memecah protein menjadi gugus benzena atau akan terjadinya nitrasi pada gugus benzen yang terdapat dalam molekul protein sehingga terbentuk endapan berwarna putih. Kemudian campuran dipanaskan, yang menyebabkan campuran berwarna kuning, karena terjadi nitrasi pada inti benzena. Langkah terakhir adalah penambahan NaOH 40%, yang fungsi untuk mempertegas warna kuning jingga setelah pemanasan. Reaksi yang terjadi adalah :
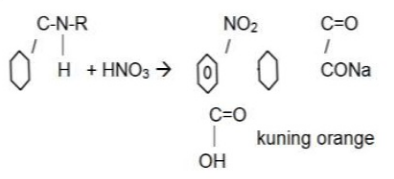
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam Praktikum Uji Protein dapat disimpulkan bahwa :
- Denaturasi adalah suatu keadaan telah terjadinya perubahan struktur protein yang mencakup perubahan bentuk dan lipatan molekul tanpa menyebabkan pemutusan atau kerusakan lipatan antar asam amino dan struktur primer protein. Faktor yang menyebabkan denaturasi adalah panas dan pH ekstrem.
- Penambahan logam berat ZnSO4 secara berlebih dapat menyebabakan protein telah lewat titik isoelektrik dan ikatan Zn pada protein menjadi terlepas.
- Ikatan peptida dapat diketahui dengan uji biuret yang akan mengahsilkan warna ungu. Sampel album, susu dan ekstrak tempe memberikan hasil uji positif.
- Pada uji ninhidrin memberikan warna ungu pada masing-masing sampel yaitu albumin, susu dan ekstrak tempe, yang menunjukkan bahwa sampel mengandung asam amino bebas.
- Pada uji xantoprotein sampel albumin, susu dan ekstrak tempe mengandung asam amino aromatik, karne memberikan uji positif karena menghasilkan warna kuning jingga.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Almatsier, S, 2004. Prinsip Dasar Ilmu Gizi. Gramedia Pustaka Utama. Jakarta.
- Bintang, Maria. 2010. Biokimia Teknik Penelitian. Jakarta: Erlangga.
- Gaman. M. 1992. Ilmu Pangan, Penghantar Ilmu Pangan, Nutrisi dan Mikrobiologi. Edisi II. Yogyakarta: Gadjah Mada University Press.
- Martoharsono. 1998. Biokimia Jilid I. Yogyakarta: Gadjah Mada. University Press.
- Poedjiadi, 1994. Dasar-Dasar Biokimia. Jakarta: Penerbit UI-Press.
- Sudarmadji, Slamet. 1989. Analisis Bahan Makanan dan Pertanian. Yogyakarta: Liberty.
- Winarno,F.G. 2004. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka
Download Laporan Praktikum [PDF]
Anda dapat Mendownload Laporan Praktikum Uji Protein dan landasan teori mengenai Uji Protein lengkap dengan pembahasan dalam format PDF dengan mengklik tombol download dibawah ini.

