Laporan Praktikum Larutan Penyangga berikut ini merupakan laporan yang admin susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
Tujuan
Berikut merupakan tujuan dari Praktikum Larutan Penyangga yakni:
- Melakukan pengujian terhadap sifat-sifat larutan penyangga dan bukan penyangga.
Latar Belakang
Larutan penyangga merupakan larutan penting yang mampu menjaga kestabilan pH. Larutan tersebut digunakan dalam berbagai bidang mulai dari kimia, mikrobiologi, biokimia hingga industri.
Tidak hanya itu, larutan penyangga juga bermanfaat bagi tubuh manusia. Beberapa contoh larutan penyangga yang menjaga pH dalam darah yaitu larutan penyangga fosfat, larutan penyangga karbonat dan larutan penyangga hemoglobin.
Apabila pH dalam darah tidak seimbang, maka fungsinya akan kacau. Keadaan tersebut akan berdampak buruk bagi kesehatan tubuh yang ditandai dengan berbagai gejala. Begitu pun juga pada tanaman yang tidak terjaga pH idealnya. Dipastikan, pertumbuhan tanaman akan terhambat.
Oleh sebab itu, pembuatan larutan penyangga wajib menggunakan bahan yang memiliki sifat menyangga. Sekalipun ditambah dengan asam dan basa, pH larutan akan tetap dalam kadar tertentu.
Beberapa bahan yang digunakan yakni NH3, NH4Cl, CH3COONa, CH3COOH, NaOH dan HCl. Dalam praktikum ini, larutan penyangga akan dibuat dari campuran CH3COONa 0,1 M dengan CH3COOH 0,1 M dan NH3 0,1 M dengan NH4Cl 0,1 M.
Dengan begitu, akan dapat diuji apakah pencampuran larutan tersebut memang bersifat penyangga. Larutan NaCl juga digunakan sebagai pembanding.
BAB II KAJIAN PUSTAKA
A. Konsep Dasar Larutan Penyangga
Definisi larutan penyangga menurut Oxtoby (2004) adalah larutan dengan pH yang dapat dikatakan tetap walaupun telah dicampur dengan sedikit takaran asam ataupun basa.
Selanjutnya, Oxtoby juga menjelaskan bahwa larutan penyangga umumnya dibuat dari campuran asam lemah dan basa lemah konjugasinya (2004). Dalam bidang fisiologis dan biokimia, larutan penyangga sangat dibutuhkan untuk mengontrol ion sekaligus mempertahankan pH.
Larutan penyangga juga dapat dibuat menggunakan campuran garam dan garam (Sunarya, 2010). Berikut rumus yang digunakan dalam penghitungan pH larutan penyangga:
Rumus untuk campuran asam lemah dengan basa konjugasi:
[su_box title=”Asam Lemah + Basa KJG” style=”bubbles” box_color=”#8bf9ff” title_color=”#000000″]

[/su_box]
Rumus untuk campuran basa lemah dengan asam konjugasi:
[su_box title=”Basa Lemah + Asam KJG” style=”bubbles” box_color=”#8bf9ff” title_color=”#000000″]
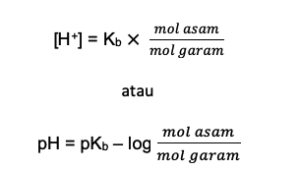
[/su_box]
B. Cara Kerja Larutan Penyangga
Larutan penyangga dapat menstabilkan pH pada rentang tertentu. Hal tersebut disebabkan oleh adanya percampuran antara larutan asam maupun basa dengan asam konjugasi ataupun basa konjugasinya.
Keuntungan dari campuran tersebut adalah memunculkan keseimbangan ion dalam larutan. Dengan begitu, pH awal cenderung tetap dan tidak mengalami baik kenaikan maupun penurunan yang signifikan.
Berikut gambaran singkat dari cara kerja larutan penyangga:
- Suatu larutan penyangga yang terdiri dari larutan NH4OH + NH4+. Larutan yang pertama berjenis basa lemah sedangkan larutan yang kedua merupakan asam konjugasinya. Apabila campuran larutan tersebut ditetesi dengan sedikit basa, maka akan muncul reaksi antara ion OH– dengan ion positif yang ada pada NH4+. Dampaknya, pH larutan tidak terpengaruh.
- Suatu larutan penyangga terbuat dari pencampuran CH3COOH dan CH3COO–. Larutan yang pertama adalah asam lemah sedangkan larutan kedua merupakan basa konjugasinya.
Saat dicampur dengan sedikit asam, maka akan memunculkan reaksi antara ion H+ dengan ion negatif yang ada pada CH3COO–. Oleh sebab itu, pH larutan dapat dipertahankan.
C. Jenis Larutan Penyangga
Terdapat dua jenis larutan penyangga yaitu:
1. Larutan Penyangga Basa
Pengertian dari larutan penyangga basa adalah suatu larutan yang mampu mempertahankan pH awal pada daerah basa yang angkanya lebih besar dari 7. Pembuatan larutan jenis ini dapat menggunakan campuran:
- Basa lemah dan asam konjugasinya (B + BH+). Salah satu contohnya adalah campuran larutan amonia dan amonium klorida;
- Basa lemah dan asam kuat. Syarat utama dalam percampuran ini adalah asam kuat harus bereaksi dengan tuntas sehingga meninggalkan asam konjugasi (garam) di akhir.
2. Larutan Penyangga Asam
Suatu larutan yang pH pada daerah asam tidak berubah disebut dengan larutan penyangga asam. Angka pH yang dikatakan asam ketika jumlahnya kurang dari 7. Campuran bahan yang dapat digunakan untuk membuat larutan penyangga asam yakni:
- Asam lemah dan garamnya. Salah satu contohnya adalah percampuran antara larutan asam asetat dan natrium asetat;
- Asam lemah dan basa kuat. Syarat utamanya adalah basa kuat harus mengalami reaksi yang tuntas hingga meninggalkan basa konjugasi (garam).
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum larutan penyangga ini kami lakukan pada:
Hari: Rabu / 04 November 2020
Tempat: Laboratorium Kimia
B. Alat dan Bahan
Adapun alat dan bahan yang kami gunakan dalam praktikum ini yakni:
[su_box title=”Alat + Bahan Praktikum” style=”bubbles” box_color=”#cb0044″ title_color=”#ffffff”]
Alat
- Gelas Ukur
- Bulb
- Kertas Lakmus
- Pengaduk
- Pipet Tetes
- Pipet Ukur 1 ml dan 10 ml
- Pengukur pH
- Gelas Beker 100 ml dan 250 ml
Bahan
- CH3COOH 0,1 M
- CH3COONa 0,1 M
- NaCl 0,1 M
- HCl 0,01 M
- NaOH 0,01 M
- NH4Cl 0,1 M
- NH3 0,1 M
- Aquades[/su_box]
C. Prosedur Kerja
Langkah kerja yang kami lakukan dalam praktikum larutan penyangga ini terbagi menjadi 3 yakni pembuatan larutan penyangga asetat, larutan penyangga NaCl dan larutan penyangga salmiak. Berikut tiap-tiap prosedurnya:
1. Pembuatan Larutan Penyangga Asetat
- Mengambil larutan CH3COONa 0,1 M dengan takaran 35 ml;
- Mengambil larutan CH3COOH 0,1 M dengan takaran 35 ml;
- Mencampurkan kedua larutan tersebut di dalam gelas beker yang berukuran 250 ml;
- Mengaduk larutan hingga tercampur sempurna dan mengukur pH memakai pH meter yang sebelumnya telah dikalibrasi dan kertas lakmus;
- Mengambil campuran larutan CH3COONa 0,1 M dan CH3COOH 0,1 M sebanyak 70 ml kemudian membagi ke 3 gelas beker yang berukuran 100 ml. Berikut panduan pembagiannya:
- Gelas Beker A : campuran larutan 20 ml + HCl 0,01 M dengan takaran 10 ml
- Gelas Beker B : campuran larutan 20 ml + NaOH 0,01 M dengan takaran 10 ml
- Gelas Beker C : campuran larutan 20 ml + aquades dengan takaran 20 ml
- Mengaduk campuran yang ada dalam tiap gelas beker dengan pola huruf “W” dan mengukur larutan menggunakan pH meter dan kertas lakmus.
2. Pembuatan Larutan Penyangga NaCl
- Mengambil larutan NaCl menggunakan gelas ukur sebanyak 70 ml;
- Mengukur pH larutan NaCl menggunakan pH meter yang telah dikalibrasi dan kertas lakmus;
- Membagi larutan NaCl ke dalam 3 gelas beker. Berikut prosedur pembagiannya:
- Gelas Beker A : larutan NaCl 20 ml + HCl 0,1 M sebanyak 10 ml
- Gelas Beker B : larutan NaCl 20 ml + NaOH 0,1 M sebanyak 10 ml
- Gelas Beker C : larutan NaCl 20 ml + aquades 20 ml
- Mengaduk campuran larutan dalam gelas beker dengan gerakan membentuk huruf “W”;
- Mengukur pH larutan menggunakan pH meter dan kertas lakmus.
3. Pembuatan Larutan Penyangga Salmiak
- Mengambil larutan NH3 0,1 M dengan takaran 35 ml;
- Mengambil larutan NH4Cl 0,1 M dengan takaran 35 ml;
- Mencampurkan larutan NH3 dan NH4Cl ke dalam gelas beker berukuran 250 ml dan mengaduk hingga rata sempurna;
- Mengukur tiap pH larutan menggunakan pH meter dan kertas lakmus;
- Membagi campuran larutan sebanyak 70 ml ke dalam 3 gelas beker. Ketentuan pembagiannya adalah:
- Gelas Beker A : campuran larutan + HCl 0,01 M dengan takaran 10 ml
- Gelas Beker B : campuran larutan + NaOH 0,01 M dengan takaran 10 ml
- Gelas Beker C : campuran larutan + aquades dengan takaran 20 ml
- Mengaduk campuran larutan dalam tipa gelas beker;
- Mengukur pH larutan memakai pH meter dan kertas lakmus.
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
Berikut tabel yang berisi hasil dari pembuatan dan pengujian terhadap larutan asetat, larutan garam dan larutan salmiak:

B. Pembahasan
Konsep dasar dari larutan penyangga adalah suatu larutan yang cenderung mempertahankan pH awal walaupun ditambah sedikit asam, sedikit basa ataupun diencerkan.
Berdasarkan data pengamatan yang ada pada tabel, maka diketahui bahwa larutan NaCl bukan termasuk larutan penyangga atau buffer. Alasannya adalah larutan tersebut tidak terbuat dari campuran asam/basa dengan pasangan konjugasi yang didapat dari garam larutan tersebut.
Selain itu, larutan NaCl tidak dapat mempertahankan pH setelah ditambahkan dengan asam/basa. Begitu pun juga saat diencerkan menggunakan air suling (aquades). Bahkan saat ditambah dengan asam kuat HCl 0,1 M, jumlah pH nya menurun drastis dari 7,72 menjadi 1,16.
Sedangkan saat larutan NaCl ditetesi dengan basa kuat NaOH 0,1 M, jumlah pH naik menjadi 12,12. Oleh sebab itu, dapat dibuktikan bahwa NaCl tidak tergolong dalam larutan buffer.
Selanjutnya, dapat dikatakan bahwa larutan salmiak merupakan larutan penyangga. Larutan tersebut telah memenuhi dua syarat utama untuk dikatakan sebagai larutan buffer.
Pertama, salmiak terbuat dari larutan NH3 yang merupakan basa lemah dan larutan NH4Cl yang merupakan larutan garam. Kedua, larutan salmiak cenderung mampu mempertahankan angka pH setelah dicampur dengan asam/basa dan aquades.
Pada pengukuran awal, didapat pH 11,75. Lalu, setelah dicampurkan dengan NaOH, pHnya berubah sedikit menjadi 11,70.
Begitu pula saat ditetesi dengan larutan asam kuat HCl, perubahan pH hanya sedikit yakni 11,69. Terakhir, saat diaduk dengan air suling, pH larutan asetat menjadi 3,50. Artinya, tidak ada perubahan yang signifikan.
Kemudian, larutan asetat juga termasuk dalam larutan penyangga. Dengan alasan yang sama, larutan asetat terdiri dari CH3COOH yang merupakan asam lemah dan CH3COONa yang merupakan larutan garamnya.
Selain itu, larutan asetat juga cenderung memiliki pH yang stabil. Jumlah pH awal terukur 3,50 dan saat ditambah dengan NaOH menjadi 3,49. Sedangkan saat dicampurkan dengan HCl, pH larutan salmiak menjadi 3,47 dan saat diencerkan di dalam air suling menjadi 3,50.
BAB V PENUTUP
Kesimpulan
Praktikum larutan penyangga ini menghasilkan beberapa kesimpulan berikut ini:
- Pembuatan larutan penyangga harus sesuai dengan takaran sebab kesalahan sedikit saja akan berpengaruh pada kekeliruan dalam pengukuran pH;
- Penambahan HCl yang merupakan asam kuat dan NaOH yang merupakan basa kuat ke dalam larutan penyangga tidak akan mengubah pH secara signifikan;
- Pengenceran larutan penyangga menggunakan air suling sama sekali tidak mempengaruhi pH awal dari larutan tersebut.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Oxtoby D.W, Gillis H.P., Nachtrieb N.H., (Penerjemah: Suminar Setiati Achmad),]. 2001. Prinsip-Prinsip Kimia Modern, Edisi keempat. Jakarta: Penerbit Erlangga.
- Sunarya, Yayan. 2010. Kimia Dasar 1 Berdasarkan Prinsip-Prinsip Kimia Terkini. Bandung: Yrama Widya.
Download Laporan Praktikum (PDF)
Anda Dapat Mendownload laporan Praktikum Larutan Penyangga ini dalam format PDF dengan mengklik tombol download dibawah ini.
[su_spoiler title=”Download / Unduh” style=”fancy” icon=”chevron-circle”]
Download File
PDF (147 KB)[/su_spoiler]
