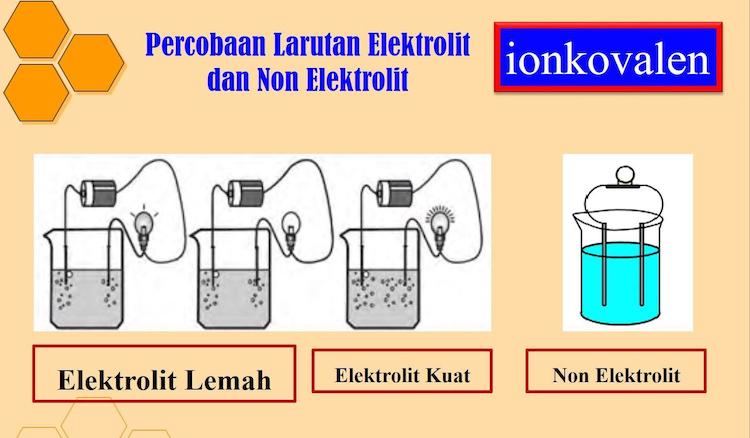
Laporan Praktikum Daya Hantar Listrik berikut ini merupakan laporan yang admin susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
Tujuan
Adapun tujuan dalam praktikum Daya Hantar Listrik ini, yakni:
- Menentukan daya hantar listrik yang berasal dari berbagai larutan.
- Menentukan pengaruh konsentrasi pada larutan terhadap daya hantar listrik yang dimiliki.
Latar Belakang
Listrik adalah salah satu hal yang sering digunakan pada kehidupan sehari-hari. Banyak orang yang bergantung terhadap penggunaan listrik untuk mempermudah pekerjaannya dalam berbagai hal. Setiap listrik sebenarnya memiliki daya hantar masing-masing. Hal tersebut berfungsi untuk menentukan jumlah arus yang bisa mengalir pada listrik tersebut.
Alasan listrik bisa mengalih adalah karena keberadaan arus elektron yang melewati suatu hambatan. Sedangkan arus elektron sendiri didapatkan dari berbagai bahan yang bisa menjadi ion seperti NaCl (garam dapur).
Suatu NaCl dalam bentuk larutan atau lelehannya bisa menghantarkan arus listrik, sehingga bisa dipakai untuk menyalakan sebuah lampu LED. Contoh bahan lainnya adalah asam cuka, meskipun tidak sebaik NaCl dalam menghantarkan arus listrik.
Berbeda dengan larutan di atas, gula dan urea tidak bisa dipakai untuk menghantarkan arus listrik yang selanjutnya disebut dengan nonelektrolit dikarenakan tidak bisa terionisasi seperti CH3COOH maupun NaCl. Pada setiap bahan yang termasuk ke dalam elektrolit, bahan tersebut mempunyai kemampuan dalam menghantarkan listriknya dan disebut dengan daya hantar. Setiap bahan pun juga mempunyai daya hantar yang berbeda.
BAB II KAJIAN PUSTAKA
A. Daya Hantar Listrik
Daya hantar listrik merupakan ukuran kemampuan yang dimiliki oleh larutan pada saat menghantarkan listrik. Daya hantar listrik sering disebut juga dengan konduktivitas dan berbanding terbalik dengan hambatan listriknya (R). Daya hantar listrik juga mempunyai satuan berupa Ω-1cm-1.

Konduktivitas sering dipakai untuk melakukan pengukuran daya hantar pada cairan elektrolit atau larutan. Konduktivitas pun mempunyai besaran yang ditentukan dengan konsentrasi elektrolit.
Energi listrik bisa ditransfer dalam bentuk berupa hantaran melalui materi yang bermuatan listrik dan berwujud arus listrik. Hal itu berarti bahwa pembawa muatan listrik harus ada di dalam suatu materi dan adanya suatu gaya untuk menggerakkan pembawa muatan.
Pembawa muatan bisa berupa elektron, misalnya seperti logam atau bisa juga diganti dengan ion negatif dan ion positif. Muatan listrik yang mengalir akan berpindah apabila ada beda potensial di antara 2 tempat tersebut, atau bisa juga dikatakan berpindah atau mengalir dari tempat yang mempunyai potensial tinggi menuju ke yang berpotensial lebih rendah. Arus listrik terjadi pada suatu larutan adalah karena terdapat ion yang bergerak (Supriyana, 2004).
B. Hambatan Listrik
Hambatan listrik tergantung dengan konsentrasi dan jenis elektrolit.aliran listrik pada sebuah larutan elektrolit akan memenuhi suatu hukum yang disebut dengan hukum Ohm. Hukum Ohm menyatakan bahwa besaran aliran arus listrik (I) yang mengalir melalui suatu larutan akan sama dengan perbedaan potensialnya (V) dibagi dengan tahanan (R). Sehingga hukum Ohm bisa ditulis secara sistematis dengan:

Tahanan pada sebuah larutan akan bergantung dengan dimensi larutan yang lain berdasarkan pada rumus:

R = Tahanan
p = resistivitas atau tahanan spesifik dengan satuan Ω-1 cm-1
l = panjang lintasan dengan menggunakan satuan cm
A = luas penampang dengan menggunakan satuan luas cm2 (Stoker, 1993)
Rumus hambatan sendiri pada suatu penghantar yaitu:
V pada rumus di atas dinyatakan dalam satuan volt, dan I dinyatakan dalam satuan ampere. Maka hambatan tersebut dinyatakan dalam satuan ohm (Ω).
Hambatan adalah unsur lain yang juga mempunyai peran sangat penting di dalam rangkaian peralatan elektrokimia. Hambatan adalah rintangan yang ada di dalam suatu sistem terhadap arus listrik, sehingga akan menyebabkan zat mengalami pengionan akan menjadi sulit. Hubungan di antara arus GGL (Gaya Gerak Listrik) dengan tahanan yaitu:

E dalam satuan rumus di atas yaitu menggunakan volt, seangkan I memakai satuan ampere, serta R dengan satuan ohm. Sehingga rumus yang disebutkan di atas dikenal dengan hukum Ohm (Dogra, 1990).
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum daya hantar listrik ini kami lakukan pada:
Hari :
Tempat :
B. Alat dan Bahan
Adapun alat dan bahan yang digunakan dalam Praktikum Daya Hantar Listrik, yakni:
[su_box title=”Alat + Bahan Praktikum” style=”bubbles” box_color=”#cb0090″ title_color=”#ffffff”]
Alat
- Power supply
- Gelas beker
- Amperemeter
- Labu takar
- Elektroda karbon
Bahan
- Larutan NaCl
- Aquades
- Larutan CH3COOH
- Larutan gula[/su_box]
C. Prosedur Kerja atau Cara Kerja
Berikut di bawah ini berbagai prosedur kerja yang harus dilakukan pada praktikum reaksi daya hantar listrik di antaranya:
Percobaan I: Menentukan besaran daya hantar listrik dalam berbagai larutan.
- Membuat larutan CH3COOH, gula, dan NaCl masing-masing dengan konsentrasi larutan sebesar 1 M (satu molar).
- Melakukan pengukuran daya hantar listrik pada masing-masing larutan tersebut
Percobaan II: Pengaruh konsentrasi larutan terhadap daya hantar listrik yang dimiliki.
- Membuat larutan CH3COOH dan NaCl masing-masing sebanyak 4 buah dengan konsentrasi larutan sebesar 0,1 M, 0,25 M, 0,50 M, dan 1,00 M.
- Melakukan pengukuran daya hantar listrik pada tiap-tiap larutan tersebut.
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
Percobaan I: Menentukan besaran daya hantar listrik dalam berbagai larutan.

Percobaan II: Pengaruh konsentrasi larutan terhadap daya hantar listrik yang dimiliki.

- Larutan Gula

2. Larutan NaCl

3. Larutan CH3COOH

B. Pembahasaan
Pada percobaan pertama, untuk menentukan daya hantar listrik pada larutan memakai larutan CH3COOH, NaCl, dan larutan gula dengan konsentrasi masing-masing 1 M. Kemudian dilakukan pengukuran daya hantar listrik yang dimiliki dengan menggunakan amperemeter dan power supply yang beda potensialnya sama yaitu sebesar 4, 6, dan 8 volt pada masing-masing larutan.
Hasil yang diperoleh dari pengamatan larutan gula adalah sebesar 2,00 x 10-3, 1,67 x 10-3, dan 1,38 x 10-3 Ω-1. Sedangkan pada larutan NaCl mendapatkan hasil sebesar 11,25 x 10-3, 15 x 10-3, dan 17,5 x 10-3 Ω-1, serta pada larutan CH3COOH sebesar 11,25 x 10-3, 15 x 10-3, 17,5 x 10-3 Ω-1.
Dari data yang diperoleh, dapat diambil kesimpulan bahwa larutan NaCl mempunyai daya hantar paling tinggi apabila dibandingkan dengan larutan gula dan CH3COOH. Larutan CH3COOH sendiri memiliki daya hantar lebih tinggi daripada larutan gula.
Pada Percobaan II, larutan yang dipakai tetap sama namun diberi tambahan variasi konsentrasi sebesar 0,1 M; 0,25 M; 0,50 M; serta 1,0 M pada setiap larutan yaitu dengan cara ditambahkan aquades. Pada konsentrasi larutan 0,1 M diambil larutan murni sebesar 1 ml, lalu ditambahkan dengan aquades sampai dengan 100 ml.
Konsentrasi 0,25 M diambil larutan murni sebesar 25 ml dengan konsentrasi 1 M, dan ditambahkan aquades 100 ml. Begitu juga dengan konsentrasi 0,50 M diambil larutan murni sebesar 50 ml dan ditambahkan aquades 100 ml, serta konsentrasi 1,0 M diambil larutan murni sebesar 100 ml dengan konsentrasi 1 M tanpa diberi tambahan aquades. Langkah-langkah tersebut berlaku pada setiap larutan, selanjutnya dilakukan pengukuran daya hantar listrik yang dimiliki.
Sehingga diperoleh tabel hasil pengamatan sebagai berikut:

Sehingga dari data percobaan di atas bisa dinyatakan bahwa konsentrasi larutan berbanding lurus dengan daya hantarnya, yaitu apabila larutan mempunyai konsentrasi yang lebih tinggi maka daya hantar yang dihasilkan juga tinggi.
BAB V PENUTUP
Kesimpulan
Dari Praktikum Daya Hantar Listrik di atas, dapat disimpulkan bahwa:
- Daya hantar yang dimiliki oleh larutan gula < CH3COOH < NaCl dengan konsentrasi sebesar 1 M.
- Konsentrasi larutan sangat berpengaruh terhadap daya hantarnya dengan besaran yang berbanding lurus, semakin besar konsentrasinya maka daya hantar listrik yang dimiliki juga semakin besar. (1,00 M > 0,50 M > 0,25 M > 0,1 M ).
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Dogra. 1990. Kimia Fisik dan Soal-soal. Jakarta: UI-Press.
- Supriyana. 2004. Kimia untuk Universitas jilid II. Jakarta: Erlangga.
Download Laporan Praktikum (PDF)
Anda Dapat Mendownload laporan Praktikum Daya Hantar Listrik ini dalam format PDF dengan mengklik tombol download dibawah ini.
[su_spoiler title=”Download / Unduh” style=”fancy” icon=”chevron-circle”]
Download File
PDF (161 KB)[/su_spoiler]