Download Laporan Praktikum Pengamatan Ilmiah dan Stoikiometri dan landasan teori mengenai pengamatan ilmiah dan stoikiometri lengkap dengan pembahasan dalam format PDF. Laporan Praktikum ini merupakan kelanjutan dari Laporan Praktikum kimia yang pernah admin bahas minggu lalu, laporan ini admin susun dari berbagai sumber agar informasi yang di berikan lebih banyak.
Tujuan :
- Memperoleh pengamatan dalam mencatat dan menjelaskan pengamatan percobaan
- Mengembangkan keterampilan dalam menangani alat kaca dan mengalihkan bahan kimia padat maupun cair
- Membiasakan diri dengan tatacara keselamatan kerja di laboratorium
- Menentukan peguraian reaksi KClO3
- Menghitung volume molar gas oksigen pada keadaan STP
- Menghitung persentasi O dalam KClO3
Kajian Pustaka
Kimia merupakan ilmu yang termasuk rumpun IPA, oleh karenanya kimia mempunyai karakteristik sama dengan IPA. Karakteristik tersebut adalah objek ilmu kimia, cara memperoleh, serta kegunaannya. Kimia merupakan ilmu yang pada awalnya diperoleh dan dikembangkan berdasarkan percobaan (induktif) namun pada perkembangan selanjutnya kimia juga diperoleh dan dikembangkan berdasarkan teori (deduktif) (Depdiknas, 2006). Sejalan dengan hal tersebut menurut BSNP (2006), ilmu kimia merupakan salah satu cabang Ilmu Pengetahuan Alam (IPA), yang secara garis besar mencakup dua bagian, yakni kimia sebagai proses dan kimia sebagai produk. Kimia sebagai produk meliputi sekumpulan pengetahuan yang terdiri atas fakta-fakta, konsep-konsep, dan prinsip-prinsip ilmu kimia. Sedangkan kimia sebagai proses meliputi keterampilan-keterampilan dan sikap yang dimiliki oleh para ilmuwan untuk memperoleh dan mengembangkan produk kimia.
Kimia mengkaji sifat zat. Secara khusus, mengkaji reaksi yang mentransformasi suatu zat menjadi zat lain. Kimia menyediakan pedoman untuk menyesuaikan sifat-sifat zat yang ada agar dapat memenuhi beberapa kebutuhan atau penerapan khusus dan menciptakan bahan yang benar-benar baru yang dirancang sejak awal agar memiliki sifat tertentu yang diinginkan (Oxtoby.et al, 2001).
Ilmu kimia mempelajari bangun (struktur) materi dan perubahan-perubahan yang dialami materi ini dalam proses-proses alamiah maupun dalam eksperimen yang direncanakan. Melalui kimia kita mengenal susunan (komposisi) zat dan penggunaan bahan-bahan tak bernyawa, baik alamiah maupun buatan, dan mengenal proses-proses penting dalam benda hidup, termasuk tubuh kita sendiri. Perspektif kimiawi dunia di sekitar kita mempesonakan. Perspektif ini dapat dikembangkan lewat pengamatan dan eksperimen kita sendiri, yang dengan kuat didasarkan pada keinginan manusiawi untuk memahami dan pencarian kita akan tatanan (Keenan, 1986: 2).
Stoikiometri (stoy-kee-ah-meh-tree) berasal dari bahasa Greek stoicheion yang berarti unsur dan metron yang berarti pengukuran. Bidang bahasan stoikiometri menyangkut studi kuantitatif atau pengukuran, yang berhubungan dengan banyaknya unsur dalam senyawa (dalam beberapa pustaka disebut stoikiometri komposisi) dan banyaknya zat dalam reaksi kimia (stoikiometri reaksi). Secara sederhana, stoikiometri merujuk pada perbandingan unsur dalam molekul dan perbandingan zat dalam reaksi-reaksi kimia.
Stoikiometri merupakan ilmu yang menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (Alfian, 2009:1). Hal tersebut juga diperjelas oleh Winarni, dkk (2013:44) yang menyatakan bahwa materi stoikiometri merupakan kajian tentang hubungan-hubungan kuantitatif dalam reaksi kimia. Pemaknaan lebih luas menjelaskan bahwa stoikiometri mempelajari aspek kuantitatif rumus dan reaksi kimia, hal tersebut diperoleh melalui pengukuran massa, volume, jumlah dan sebagainya yang terkait dengan atom, ion atau rumus kimia serta saling keterkaitannya dalam suatu mekanisme reaksi kimia (Ernawati, 2015:18).
Pada stoikiometri komposisi terdapat istilah kesetaraan stoikiometri. Kesetaraan stoikiometri dari dua jenis unsur dalam suatu rumus kimia adalah perbandingan mol dari unsur-unsur tersebut sesuai dengan yang tercantum dalam rumus kimianya. Stoikiometri reaksi mencakup semua tahap penting dalam perhitungan yang menggunakan persamaan kimia setara. Perhitungan tersebut dilakukan untuk meramalkan hubungan antara jumlah pereaksi dan hasil reaksi dalam suatu reaksi kimia. Penerapan konsep stoikiometri yang paling umum dilakukan di laboratorium adalah ketika harus menghubungkan massa pereaksi yang diperlukan dengan massa produk yang diinginkan.
Menurut Onggo (2013), stoikiometri adalah kajian massa spesi kimia pada suatu reaksi kimia secara kuantatif. Stoikiometri berdasarkan pada 3 hukum kimia, yaitu :
- Hukum kekekalan massa zat sebelum dan sesudah reaksi adalah sama. (hukum lavoiser)
- Hukum perbandingan tetap: pada suatu senyawa kimia perbandingan massa setiap unsur pembentuk senyawa tersebut tetap.(Hukum proust)
- Hukum perbandingan berganda : jika dua unsur membentuk senyawa maka perbandingan massa setiap unsur pembentuk senyawa tersebut merupakan angka sederhana.
Secara umum, terdapat tiga tahap dalam perhitungan stoikiometri reaksi, yaitu:
- Mencari pereaksi atau hasil reaksi yang diketahui massanya dalam cuplikan dan rumus kimianya. Menggunakan berat molekul zat tersebut untuk mengubah gram cuplikan menjadi mol. Tahap ini adalah suatu perhitungan yang secara langsung mengubah massa menjadi mol.
- Menggunakan angka koefisien dalam persamaan reaksi setara untuk membuat perbandingan mol yang dapat mengubah mol zat tersebut menjadi mol suatu zat lainnya dalam reaksi tersebut.
- Menggunakan berat molekul dari zat lain itu untuk mengubah mol zat tersebut menjadi gram. Seperti pada tahap pertama, ini adalah perhitungan massa zat dari molnya. Di sini digunakan stoikiometri dari persamaan kimia.
Untuk sampai pada tahap perhitungan stoikiometri reaksi maka ada satu tahap penting yang terpadu dengan perhitungan tersebut yaitu penyetaraan persamaan kimia. Meskipun tidak ada satu cara yang pasti dalam penyetaraan persamaan kimia, tapi secara umum langkah-langkahnya bisa dirumuskan sebagai berikut :
- Mengidentifikasikan semua pereaksi dan hasil reaksi kemudian menuliskan rumus molekul yang benar, masing-masing pada sisi kiri dan kanan persamaan
- Menyetarakan persamaan tersebut dengan mencoba berbagai koefisien tetapi tidak mengubah angka subskrip
- Penyetaraan bisa diawali dari unsur yang hanya muncul sekali di kedua sisi persamaan, baru kemudian menyetarakan juga unsur yang muncul lebih dari sekali
- Memeriksa ulang hasil penyetaraan untuk memastikan jenis dan jumlah unsur sebelum reaksi sama dengan sesudah reaksi.
METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum pengamatan ilmiah dan stoikiometri ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Berikut ini merupakan alat dan bahan yang kami gunakan dalam praktikum pengamatan ilmiah dan stoikiometri ini, sebagai berikut:
Alat
- tabung reaksi
- gelas piala
- sudip
- erlenmeyer
- pengaduk
- labu florence
- kaca arloji
- gelas ukur
- klem penjepit
- neraca
Bahan
- larutan biru (10gr glukosa dalam 50ml KOH 0,5M dan 10ml larutan biru metil 0,1g/L)
- gula pasir
- asam sulfat pekat
- etanol
- aquades
- amonium sulfat
- serbuk zink
- amonium klorida
- kalsium klorida
- asam nitrat pekat
- larutan tembaga (II) sulfat
- merkuri (II) nitrat
- larutan kalium iodida
- KClO3
- MnO2
- logam tembaga
- kertas saring
- amonium nirtrat
- paku besi
- logam kalsium
C. Prosedur Kerja atau Cara Kerja
Berikut ini berbagai langkah dalam praktikum pengamatan ilmiah dan stoikiometri :
Demosntrasi oleh asisten
a. Warna biru yang sirna
- Masukkan larutan biru kedalam labu flourence
- Angkat labu, kemudian kocok dengan ibu jari memegang tutup
- Ulangi pengocokan 2-3 kali, amati hasil
b. Asbut (smog) tembaga
- Masukkan sekeping logam tembaga ke dalam erlenmeyer
- Tuangkan asam nitrat pekat ke dalam labu hingga seluruh kepingan logam terendam
- Tutup labu rapat-rapat. (Setelah logam berhenti bereaksi kosongkan isi labu kedalam gelas piala berisi air)
c. Busa hitam
- Masukkan gula pasir ke dalam gelas piala 150ml sampai setengah terisi
- Tambahkan 15ml asam sulfat pekat, aduk hati-hati dengan pengaduk kaca
d. Kalor
- Masukkan 60 ml aquades ke dalam gelas piala. Tambahkan 40 ml etanol
- Ambil kertas saring, dan rendam dalam larutan alkohol
- Peras kelebihan larutan, bentangkan pada kaca arloji lalu bakar
e. Bahaya air
- Gerus sekitar 3 gr amonium nitrat pada lumpang
- Alihkan serbuk ke dalam cawan penguap
- Taburkan serbuk zink segar pada serbuk amonium nitrat
- Mundur beberapa langkah dan semprotkan air pada botol semprot kepada campuran bahan kimia tadi (Reaski yag terjadi sangat eksoterm sehingga harus dilakukan dengan hati-hati. Beberapa butir kristal iodin akan memperbesar efek ini).
Percobaan oleh praktikan
a. Panas dan dingin
- Masukkan seujung sudip amonium klorida ke dalam tabung reaksi I
- Masukkan seujung sudip kalsium klorida ke dalam tabung reaksi II
- Isilah kedua tabung hingga setengahnya dengan aquades, peganglah bagian bawah tabung
b. Aktif dan tidak aktif
- Masukkan aquades ke dalam gelas piala 250ml hingga setengahnya
- Masukkan paku besi dan sekeping logam kalsium ke dalam aquades tersebut
- Catat pengamatan dan ajukan hipotesis
c. Paku tembaga
- Masukkan larutan tembaga (II) sulfat ke dalam gelas piala 250ml
- Tambahkan paku besi , tunggu beberapa menit, dan catat pengamatan
d. Ada dan hilang
- Masukkan 10ml merkuri (II) nitrat ke dalam gelas ukur
- Tambahkan 20ml larutan kalium iodida, dan aduk isinya. Catat pengamatan dan ajukan hipotesis
Stoikiometri
a. Persiapan alat
- Pasanglah alat seperti gambar
- Tes alat terhadap kebocoran menggunakan langkah 3 hingga 6
- Isilah labu florence dengan air hingga hampir penuh dan buka klem penjepit
- Lepaskan selang karet pada bagian atas labu florence yang berhubungan dengan tabung reaksi. Tiuplah melalui pipa kaca hingga selang karet terisi penuh air. Air akan mengalir dari labu ke gelas piala
- Hubungkan kembali selang karet dengan pipa kaca pendek pada labu florence, selama air masih mengalir
- Jika tidak ada kebocoran, tidak ada lagi air yang akan mengalir dari labu ke gelas piala
- Jepit selang karet dengan slang penjepit, dan kosongkan gelas piala.
b. Percobaan stoikiometri
- Dalam keadaan bersih dan kering, timbang tabung reaksi pyrex 200mm dalam keadaan kosong menggunakan neraca degan ketelitian 0,001d
- Timbang sekitar 0,2g KClO3 dengan ketelitian 0,001g dalam tabung reaksi lalu tambahkan 0,03g MnO2
- Homogenkan KClO3 dengan MnO2 dalam tabung reaksi
- Pasang tabung reaksi yang berisi KClO3 dengan MnO2 menggantikan tabung reaski kosong pada alat yang telah disiapkan
- Dengan api spritus panaskan dasar tabung reaksi yang mengandung campuran KClO3 dan MnO2 sekitar 1 menit, dan buka klem penjepit
- Lanjutkan pemanasan hingga tidak ada lagi air yang mengalir dari selang karet ke gelas piala (Selama pengaliran air, tekanan dalam alat dan udara diusahakan sama, dengan cara mengatur tinggi permukaan air di dalam labu dan gelas piala)
- Setelah tidak ada lagi air yang menetes (sekitar 30 menit pemanasan) selang akret dijepit kembali dan padamkan api
- Air dari gelas kimia diukur volumenya dengan gelas ukur, dan catat suhu air ini
- Setelah tabung reaksi dingin, lepaskan tabung reaksi dan bersihkan lalu ditimbag dengan ketelitian 0,001g
- Catat tekanan dan suhu udara di laboratorium
- Lakukan percobaan ini dua kali dari
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
Demonstrasi oleh Asisten
a. Warna biru yang sirna

b. Asbut (smog) tembaga

c. Busa hitam

d. Kalor

e. Bahaya air

Percobaan oleh praktikan
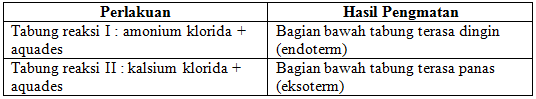
a. Panas dan dingin
b. Aktif dan tidak aktif

c. Paku tembaga

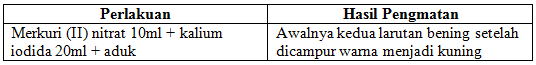
d. Ada dan hilang
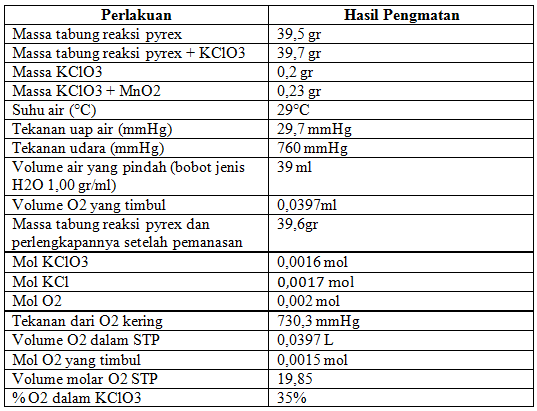
Stoikiometri
B. Pembahasan
Adapun pembahasan dalam laporan praktikum pengamatan ilmiah ini adalah sebagai berikut :
Pada praktikum pengamatan ilmiah dan stoikiometri kali ini, kali melakukan beberapa percobaan yang didemonstrasikan oleh asisten praktikum dan kali lakukan secara mandiri. Percobaan yang didemonstrasikan oleh asisten meliputi warna biru yang sirna, asbut (smog) tembaga, busa hitam kalor, dan bahaya air. Percobaan yang kami lakukan sendiri adalah panas dan dingin, aktif dan tidak aktif, paku tembaga, ada dan hilang, serta percobaan stoikiometri.
Demonstrasi oleh Asisten
a. Warna biru yang sirna
Untuk menciptakan larutan biru asisten praktikum mencampurkan 10gr glukosa dalam 50ml KOH 0,5M kemudian ditambahkan 10ml larutan biru metil 0,1g/L yang dicampurkan ke dalam labu florence. Campuran yang didapat adalah berwarna biru pekat. Kemudian campuran dikocok dengan ibu jari memegang tutup, warna biru yang semula pekat menjadi sirna atau bening. Sirnanya warna biru yang ada pada campuran tersebut karen ion OH pada KOH berikatan dengan H+ yang berasal dari glukosa. Penetralan ini menghasilkan air sehingga air menyebabkan warna dalam larutan menjadi sirna. Hal itu juga dikarenakan glukosa merupakan zat elektrolit yang bersifat netral pada air, ketika bereaksi dengan KOH yang merupakan elektrolit kuat dapat membuat warna birru menjadi sirna.
b. Asbut (smog) tembaga
Demontrasi kedua yang dilakukan oleh asisten adalah asbut (smog) tembaga. Perlakuan pertama adalah memasukkan tembaga ke dalam erlenmeyer, kemudian kami menambahkan asam nitrat pekat hingga seluruh permukaan tembaga tertutupi asam nitrat pekat, dan kami segera menutup labu erlenmeyer dengan rapat. Terdapat gelembung dalam labu, dan warna dari keping tembaga menjadi biru, kemudian terlihat pada pinggir labu berwarna coklat. Reaksi yang terjadi adalah :
Cu + 2HNO3 –> Cu(NO3)2 + H2
Warna biru yang tercipta adalah Cu(NO3)2 sedangkan gelembungb yang tercipta berasal dari gas H2. Setelah logam berhenti bereaksi kosongkan isi labu kedalam gelas piala berisi air. Hal ini mengakibatkan logam berwarna putih kembali.
c. Busa hitam
Pada demonstrasi ketiga ini bahan yang digunakan adalah gula pasir (sukrosa) dan asam sulfat pekat. Gula pasir di masukkan ke dalam gelas kimia kemudian kami menambahkan 15ml asam sulfat pekat , warna campuran menjadi hitam, kemudian menjadi busa padat yang semakin naik. Saat penambahan asam sulfat pekat (H2SO4) ke dalam sukrosa, maka asam sulfat akan mengusir atom hydrogen (H) dan oksigen (O) dari senyawa itu karena afinitas asam sulfat yang sangat tinggi. Campuran ini menghasilkan karbon dan air, air yang dihasilkan diserap oleh asam sulfat. Reaksi yang terjadi adalah :
C12H22O11 –> 12C + 11H2O
d. Kalor
Demontrasi ini diawali dengan mencampur 60ml aquades (H2O) dengan 40ml etanol (C2H5OH). Kemudian kertas saring dicelupkan pada campuran aquadus dan etanol, kami memeras dan membentangkan kertas saring tersebut pada kaca arloji lalu membakarnya. Terbentuk api yang berwarna biru, namun kertas saring tidak terbakar. Hal ini terjadi karena yang terbakar adalah etanol karena etanol bersifat mudah terbakar, sedangkan kertas saring tidak terbakar karena mengandung air.
e. Bahaya air
Pada demonstrasi terakhir ini digerus 3gr amonium nitrat sehingga terbentuk serbuk. Kemudian serbuk amonium nitrat di letakkan pada cawan penguap, asisten praktikum menaburkan serbuk zink pada amonium nitrat. Setelah itu pada kedua zat tersebut disemprotkan air menggunakan botol semprot secara hati-hati. Yang terjadi adalah zat tersebut menghasilkan busa, terdapat letupan-letupan kecil yang berasal dari gelembung gas yang tercipta, dan cawan penguap menjadi panas. Hal ini terjadi karena amonium nitrat yag bereaksi dengan serbuk zink sehingga tercipta gelembung gas.
Reaksi ini terjadi sangat eksotermik sehingga harus dilakukan dengan hati-hati. Dalam beberapa kasus reaksi ini dapat menghasilkan api dan banyak asap. Reaksi in seharusnya dilakukan di lemari asam karena reaksi terjadi sangat cepat. Zink dan amonium nitrat campuran dapat menyala dari air di udara.
Percobaan oleh praktikan
a. Panas dan dingin
Pada percobaan panas dan dingin ini kami menggunakan amonium klorida dan kalsium klorida. Kami menyiapkan dua buah tabung reaksi, pada tabung reaksi pertama kami mencampurkan amonium klorida dengan aquades. Kemudian pada tabung reaksi yang kedua kami mencampurkan kalsium klorida dengan aquades. Dari percobaan ini, untuk tabung reaksi pertama ketika diraba bagian bawah tabung dengan punggung tangan terasa dingin, sedangkan pada tabung reaksi kedua terasa panas. Hal ini dapat terjadi karena adanya reaksi kimia yang berlangsung dengan menyerap atau membebaskan kalor.
Pada tabung reaksi pertama reaksi yang terjadi adalah reaksi endoterm, yaitu sistem menyerap kalor dari lingkungan. Sedangkan pada tabung kedua terjadi reaksi eksoterm, dimana sistem membebaskan kalor ke lingkungan, sehingga entalpi sistem berkurang. Percobaan yang kami lakukan dikatakan berhasil karena sesuai dengan literatur.
b. Aktif dan tidak aktif
Pada percobaan ini dimasukkan 125ml aquades kedalam gelas piala 250 ml. Kemudian memasukkan paku besi kedalam gelas piala tersebut, dan memasukkan lagi logam kalsium kedalamnya. Pada larutan tersebut timbulnya gelembung pada paku karena adanya kalsium didalamnya, tetapi paku besi tersebut tidak aktif bereaksi dengan air.
c. Paku tembaga
Pada percobaan kali ini bahan yang digunakan adalah tembaga (II) sulfat dan paku besi. Langkah yang kami lakukan adalah larutan tembaga (II) dimasukkan kedalam gelas piala kemudian kami mencelupkan paku besi ke dalam larutan tersebut. Pada saat paku besi di masukkan terdapat gelembung disekitar paku. Setelah beberapa menit paku besi yang semula keperakan berubaha menjadi merah kecoklatan seperti berkarat. Hal ini dapat terjadi karna adanya reaksi reduksi dan oksidasi. Jika dilihat dari reaksi pendesakan logam. Reaksiny adalah:
Fe(s) + CuSo4(aq) –> Cu(s) + FeSO4(aq)
Reaksi ionnya adalah :
Fe(s) + Cu2+(aq) –> Cu(s) + Fe2+(aq)
Reaksi ini terjadi karena logam Fe lebih reaktif daripada logam Cu, berdasarkan kereaktifannya : K, Ba, Ca, Na, Mg, al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
d. Ada dan hilang
Pada percobaan ada dan hilang bahan yang digunakan adalah merkuri (II) nitrat dan kalium iodida. Kedua larutan ini tidak berwarna atau bisa dikatakan bening. Ketika mencampurkan 20ml larutan kalium iodida ke dalam 10 larutan merkuri (II) nitrat seketika warna larutan menjadi kuning. Warna kuning tersebut berasal dari HgI2, yang mengendap perlahan-lahan pada dasar wadah. Reaksi yang terjadi adalah :
Hg(NO3)2 + 2KI –> HgI2 + 2KNO3
Stoikiometri
Sebelum kita melakukan percobaan terakhir yakni stoikiometri, kita harus mempersiapkan alat dan bahan terlebih dahulu. Alat tersebut harus dites terlebih dahulu agar kita mengetahui bocor atau tidak alat tersebut. Jika alat tidak bocor, maka segeralah isi labu Florence dengan air hingga hamper penuh dan buka klem penjepit. Kemudian lepaskan selang karet bagian atas labu Florence yang berhubungan dengan tabung reaksi. Tiup melalui pipa kaca, air akan mengalir dari labu ke gelas piala. Hubungkan kembali selang karet dengan pipa kaca pendek pada labu Florence, selama air masih mengalir, kemudian jepit selang karet dengan penjepit dan kosongkan gelas piala. Setelah itu, lakukan percobaan menurut langkah-langkah prosedur yang ada.
Pada percobaan ini, bahan yang digunakan adalah KClO3 jika KClO3 dipanaskan, akan menghasilkan gas oksigen. Pada pemanasan digunakan katalis MnO2 untuk mempercepat reaksi menjadi oksigen. Reaksi yang terjadi adalah sebagai berikut :
2KClO3(s) –> 2KCl(s) + 3O2(g)
Percobaan ini bertujuan untuk mencari koefesien reaksi pengukuran reaksi KClO3 (penyetaraan reaksi), menghitung volume molar gas oksigen pada keadaan STP, dan menghitung persentase O2 dalam KClO3. Perhitungannya adalah sebagai berikut :
a. Mencari mol KClO3
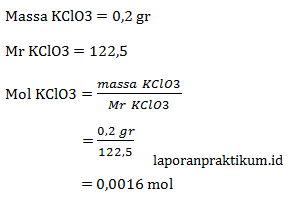
b. Mencari mol KCl

c. Mencari mol O2

d. Menentukan volume molar O2 dan % dalam KClO3


BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dalam praktikum pengamatan ilmiah dapat disimpulkan bahwa :
- Dengan adanya percobaan pengamatan ilmiah diperoleh pengalaman dalam mencatat data dan menjelaskan data pengamatan ke dalam pembahasan.
- Dalam melakukan perlu kehati-hatian dan ketelitian, karena bahan kimia banyak yang berbahaya.
- Koefesien reaksi penguraian KClO3 dapat diperoleh dengan cara penyetaraan reaksi dan data yang diperoleh pada percobaan dengan menggunakan perbandingan mol.
- Volume molar gas O2 dalam percobaan diperoleh sebesar 19,85 l/mol.
- Persentase O2 dalam KClO3 adalah sebesar 35%.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Alfian, Z. 2009. Kimia Dasar. Medan : USU Press.
- Ernawati, D. 2015. Upaya Peningkatan Prestasi Belajar dan Kemampuan Berpikir Kritis Siswa Kelas X MIA 7 dengan Menggunakan Metode Pembelajaran Problem Solving pada Materi Stoikiometri di SMA Negeri 1 Sukoharjo Tahun Pelajaran 2014/2015. Jurnal Pendidikan Kimia, Vol. 4; 4, Hal 17-26.
- Depdiknas. 2006. Permendiknas No 22 Tahun 2006 Tentang Standar Isi. Jakarta : Depdiknas.
- Keenan.1986. Kimia Dasar Prinsip dan Terapan Modern Edisi Keempat. Jakarta: Erlangga.
- Onggo, Djulia. 2013 . Intisari Konsep Kimia Dasar. Yogyakarta : Graha Ilmu.
- Oxtoby, David W., et al. 2001. Prinsip-prinsip Kimia Modern. Jakarta: Erlangga.
