Laporan Praktikum Elektrolit dan Non Elektrolit berikut ini merupakan laporan yang admin susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
Tujuan
Adapun tujuan dalam Praktikum Elektrolit dan Non Elektrolit antara lain:
- Untuk mengetahui perbedaan antara larutan elektrolit lemah, kuat dan non elektrolit
- Mengetahui jenis dan ciri-ciri larutan elektrolit lemah, kuat dan non elektrolit
- Membandingkan beberapa larutan untuk mengetahui apakah termasuk ke dalam larutan lemah, kuat dan non elektrolit
Latar Belakang
Larutan memiliki peran yang cukup penting dalam beberapa aspek kehidupan sehari-hari. Salah satu contohnya adalah air mineral yang dikonsumsi oleh manusia, larutan elektrolit dan larutan air garam.
Manusia tidak menyadari bahwa dari beberapa larutan di atas ada yang mampu menghantarkan listrik jika disambungkan dengan sebuah alat tertentu. Larutan elektrolit bisa berupa asam, garam dan basa. Untuk basa dan asam bisa berupa elektrolit lemah atau kuat.
Sedangkan garam masuk ke dalam elektrolit kuat, namun jika susah larut dalam air maka termasuk elektrolit lemah walaupun tersusun dari banyak ion. Larutan elektrolit adalah larutan yang tidak mampu menghantarkan listrik karena terdapat zat non elektrolit yang tidak bisa terurai menjadi ion.
Namun tetap berbentuk molekul. Contohnya adalah larutan minyak tanah, gula, alkohol dan lain sebagainya. Pada percobaan kali ini dilakukan dengan tiga bahan yaitu pemutih, susu cair dan perasan mentimun.
BAB II KAJIAN PUSTAKA
A. Pengertian Larutan Elektrolit dan Non Elektrolit
Pengertian larutan adalah campuran dua zat atau lebih (homogen) yang memiliki kesamaan dalam zat penyusunnya, tidak bisa dibedakan secara fisik dan saling melarutkan. Disebut zat terlarut atau solut jika jumlahnya lebih sedikit di dalam larutan.
Kemudian disebut pelarut atau solven jika jumlahnya lebih banyak dibanding zat yang lainnya. Kedua komposisi baik zat solut atau solven dinyatakan dalam konsentrasi larutan sedangkan proses pencampurannya disebut dengan solvasi.
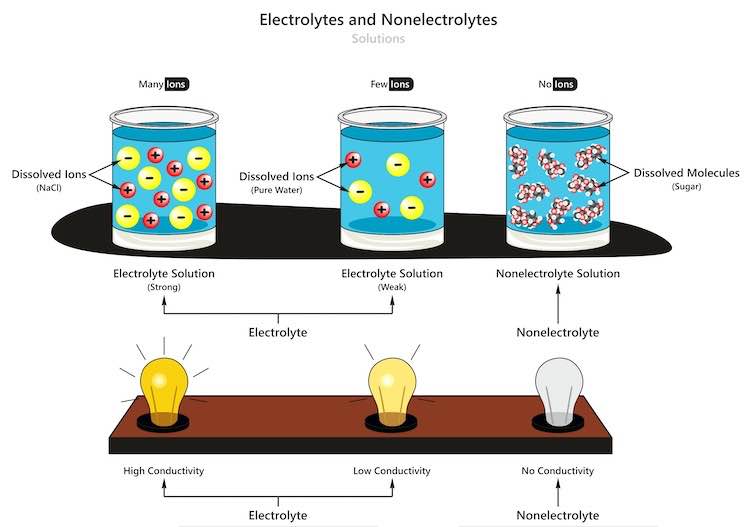
Seperti yang sudah dijelaskan di atas, larutan elektrolit merupakan larutan yang mampu menghantarkan arus listrik. Arrhenius dari Swedia mengatakan bahwa larutan elektrolit yang ada di dalam air mengalami disosiasi ke dalam partikel yang bermuatan listrik negatif dan positif.
Jumlahnya sama sehingga muatan ion dalam larutan bersifat netral. Ion inilah yang berfungsi untuk menghantarkan listrik. Ciri dari elektrolit adalah mampu membuat lampu menyala atau menimbulkan gelembung gas dalam larutan karena mengandung kation dan anion.
Sedangkan larutan non elektrolit adalah larutan yang didalamnya tidak memuat ion yang bisa menghantarkan listrik. Apabila diuji maka gelembung akan sedikit dan tidak membuat lampu bohlam menyala.
B. Asal Mula Larutan Elektrolit
Larutan elektrolit berasal dari senyawa kovalen polar atau yang memiliki ikatan ion. Disebut sebagai larutan elektrolit kuat jika mampu menghantarkan arus listrik dengan baik, zat terlarut (solut) terurai secara sempurna (derajat ionisasi =1) sehingga menjadi ion.
Tidak bisa menghantarkan listrik jika senyawa ionik berbentuk padat karena masing-masing ion sudah terikat kuat dan tidak bisa melakukan pergerakan ketika diberi beda potensial. Namun jika ionik tersebut dilarutkan dalam pelarut polar misalnya air, maka ionik tersebut menjadi elektrolit.
Ion yang awalnya sudah terikat akan terlepas, masuk dan menyebar dengan air yang secara langsung juga menjadi medium untuk bergerak. Tetapi lelehan senyawa ionik mempunyai daya hantar yang lebih baik dibandingkan dengan larutannya.
Hal tersebut bisa terjadi karena susunan ion di dalam lelehan senyawa ionik lebih rapat dibanding ketika berbentuk larutan. Ion lebih mudah bergerak menuju katoda dan anoda ketika diberi potensial yang berbeda.
Hantarannya bisa menjadi sangat kuat apabila jumlah ion dalam larutan cukup banyak, contohnya adalah NaCI. Larutan elektrolit lemah yaitu larutan yang tidak dapat menghantarkan listrik karena sifatnya lemah dan tidak terionisasi secara sempurna atau bahkan tidak sama sekali.
Hal ini dikarenakan zat terlarut hanya terurai sebagian (derajat ionisasi = 0 < α < 1) sehingga kandungan ion menjadi sedikit dan tidak mencukupi untuk menghantarkan arus listrik, contohnya adalah air biasa, NH3.
Molekul pada larutan elektrolit tidak terionisasi ke dalam larutan sehingga tidak ada yang dapat menghantarkan arus listrik (derajat ionisasi = 0). Contohnya adalah larutan urea dan glukosa.
Derajat ionisasi berbicara tentang apabila zat dilarutkan dalam air, maka terdapat 3 kemungkinan yaitu larut secara sempurna, sebagian atau tidak larut. Arti lainnya adalah perbandingan antara jumlah molekul zat yang sudah terionisasi dengan mol asal, sehingga dapat ditulis seperti berikut ini :

Artinya adalah α di antara 0 ≤ α ≥ 1. α ≤ 0 artinya adalah tidak terjadi ionisasi. Sedangkan α ≥ i maka terjadi ionisasi sempurna.
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum Elektrolit dan Non Elektrolit dilaksanakan pada:
- Hari: Kami / 5 November 2020
- Tempat: Laboratorium Kimia
B. Alat dan Bahan
Adapun alat dan bahan dalam percobaan Elektrolit dan Non Elektrolit antara lain:
- Gelas kimia
- Tisu
- Air secukupnya (pembersih elektroda)
- Baterai berukuran 9 volt
- Kabel listrik
- 6 macam larutan yaitu A, B, C, D, E dan F
- Bola lampu kecil (usahakan lampu LED 6 volt)
- Elektroda (2 buah paku)
B. Cara atau Langkah Kerja
Berikut langkah-langkah dalam Praktikum Elektrolit dan Non Elektrolit:
- Rangkaian alat seperti gambar di bawah ini:

- Pertama-tama menyiapkan larutan dari gelas kimia.
- Merangkai beberapa alat penguji seperti kabel, lampu, elektroda dan baterai.
- Menguji larutan dengan cara memasukkan kedua elektroda ke dalam larutan hingga saling bersentuhan.
- Mengamati perubahan yang terjadi, apakah lampu menyala redup, tidak menyala atau justru terang.
- Mengamati apakah terdapat gelembung, tidak ada atau sedikit.
- Setelah pengujian selesai dilaksanakan maka larutan akan dibersihkan terlebih dahulu, caranya elektroda yang sudah digunakan dibilas dengan air biasa dan dikeringkan menggunakan tisu.
- Menjaga larutan agar tidak tercampur atau terkontaminasi dengan bahan lainnya
- Mengamatinya dengan teliti hingga hasil bisa didapatkan (apakah lampu menyala dan banyaknya gelembung).
BAB IV HASIL DAN PEMBAHASAN
A. Data Hasil Pengamatan
| No | Larutan | Pengamatan | Daya Hantar Listrik (Voltmeter) |
| 1 | Susu cair | Gelembung gas sedikit Lampu tidak berhasil menyala | 27 volt |
| 2 | Perasan mentimun | Gelembung gas banyak Lampu tidak berhasil menyala | 34 volt |
| 3 | Pemutih | Terdapat gelembung gas Lampu berhasil menyala terang | 36 volt |
B. Pembahasan
Alat uji elektrolit bisa digunakan untuk mengetahui keelektrolitan suatu larutan. Berdasarkan data di atas dan percobaan yang sudah dilakukan, beberapa bisa menyalakan lampu dan menghasilkan gelembung namun ada juga yang tidak.
Larutan yang berhasil menghasilkan gelembung termasuk larutan elektrolit. Kebalikannya, jika tidak menghasilkan gelembung maka disebut dengan larutan non elektrolit. Lampu yang berhasil menyala terang menandakan bahwa suatu larutan terionisasi dengan baik.
Sedangkan larutan yang hanya mampu membuat lampu menyala redup berarti tidak dapat terionisasi dengan baik, penghantar listrik yang buruk dan lemah. Begitupun dengan larutan yang tidak dapat menghidupkan lampu, berarti tidak dapat terionisasi sama sekali.
Voltmeter adalah alat pengukur tegangan listrik yang mana jarum akan bergerak ketika terdapat arus listrik. Semakin banyak arus yang mengalir maka semakin besar pula penyimpangan jarumnya.
Berdasarkan hasil percobaan di atas dengan masing-masing larutan, uji elektroda dan setelah diamati ada atau tidaknya gelombang dan nyala lampu, maka bisa dipastikan beberapa larutan yang sudah diuji dikategorikan menjadi tiga golongan.
Pertama adalah larutan elektrolit kuat. Kedua larutan elektrolit lemah dan terakhir larutan non elektrolit. Tiga sampel di atas yaitu perasan mentimun, larutan pemutih dan susu cair diuji berdasarkan sifat larutannya apakah tidak bisa menghantarkan listrik atau sebaliknya
1. Larutan Perasan Mentimun
Pada larutan perasan mentimun lampu tidak menyala namun gelembung yang muncul lumayan banyak. Oleh karena itu dikategorikan sebagai elektrolit lemah.
Beberapa faktor penentunya adalah kandungan dalam mentimun. Terdiri dari cucumis sativus dengan kalium 147 mg per 100 gramnya yang merupakan elektrolit penting. Selain itu, juga terdapat antioksidan sebagai senyawa pemberi elektron atau reduktor.
2. Larutan Pemutih
Dalam pengujian elektrolit dan non elektrolit ini melibatkan larutan pemutih dan dimasukkan ke dalam gelas kimia. Setelah itu, dicelupkan alat uji elektroda dan ternyata terbukti menghasilkan listrik karena nyala lampu terang dan gelembung yang sangat banyak.
Hal tersebut berarti sifat elektronik adalah kuat. Reaksi ionisasi elektrolit ini merupakan reaksi berkesudahan yang mana molekul elektrolit yang netral sudah tidak ada lagi dan semuanya berubah menjadi ion.
Penyebabnya adalah zat terlarut NaCIO yang merupakan senyawa ion ketika dilarutkan ke dalam air akan membentuk sebuah ikatan antara ion negatif dan positif namun terputus dan tersebar sehingga bergerak bebas di dalam larutan. Jika dituliskan sebagai berikut :
NaClO → Na+ + ClO–
3. Susu Cair
Terakhir adalah larutan susu cair yang hasilnya adalah tidak menghantarkan listrik. Ditandai dengan lampu tidak menyala dan gelembung yang dihasilkan sedikit. Kesimpulannya susu cair merupakan larutan non elektrolit.
Namun pada pengukuran yang sudah dilakukan menggunakan voltmeter, susu cair menunjukkan angka 27 volt yang itu berarti larutan elektrolitnya dinilai lebih lemah dibandingkan mentimun.
Penyebabnya adalah jumlah sumber elektrolit yaitu kandungan dalam susu cair seperti kalium 8% dan vitamin C 8% dinilai sedikit sehingga tidak mampu menghantarkan listrik secara lebih besar.
BAB V PENUTUP
Kesimpulan
Kesimpulan dari pengujian dan percobaan di atas adalah sebagai berikut:
- larutan non elektronik merupakan larutan yang tidak bisa menghantarkan listrik. Kebalikan dari larutan elektronik yang mampu menghantarkan listrik.
- Larutan elektrolit sendiri dibagi menjadi dua yaitu kuat dan lemah.
- Dikatakan kuat jika larutan terionisasi dengan baik, dan dikatakan lemah jika ionisasi buruk atau tidak terjadi sama sekali. Tandanya adalah nyala lampu dan gelembung, semakin terang dan banyak maka suatu larutan termasuk elektrolit kuat.
- Sampel yang menunjukkan sebagai larutan elektrolit adalah larutan pemutih karena bisa menghantarkan listrik, bola lampu bisa menyala dan memiliki banyak gelembung.
- Sedangkan untuk susu cair dikategorikan sebagai larutan non elektrolit, perasan mentimun berkarakteristik larutan elektrolitnya lemah sehingga bola lampu tidak berhasil menyala. salah satu faktor yang menyebabkan gelembung pada perasan mentimun lebih banyak dibandingkan dengan susu cair adalah kandungan bahan yang ada di masing-masing bahan.
- Susu cair memiliki larutan elektrolit lebih sedikit dibandingkan dengan perasaan mentimun. Hal inilah yang membuat gelembung pada mentimun lebih banyak walaupun sama-sama tidak menyala.
Download Laporan Praktikum (PDF)
Anda Dapat Mendownload laporan Praktikum Elektrolit dan Non Elektrolit ini dalam format PDF dengan mengklik tombol download dibawah ini.
[su_spoiler title=”Download / Unduh” style=”fancy” icon=”chevron-circle”]
Download File
PDF (117 KB)[/su_spoiler]