Laporan Praktikum Alkalimetri dan Asidimetri pada larutan alkali dan alkali tanah, berikut ini merupkan laporan alkalimetri lengkap dengan landasan teorinya. Laporan ini disusun dari berbagai sumber dan referensi yang digabungkan jadi satu bagian yang utuh, silahkan di pelajari.
BAB I PENDAHULUAN
A. Latar Belakang
Untuk menentukan serta mengetahui kadar suatu senyawa dapat menggunakan berbagai macam metode. Jenis setiap metode yang akan digunakan tergantung pada jenis serta struktur kimia dar senyawa yang akan dianalisis. Salah satu metode yang dapat digunakan adalah titrasi. Titrasi adalah suatu metode yang digunakan untuk menentukan kadar suatu zatt dengan menggunakan zat lain yang konsentrasinya telah diketahui. Titrasi biasanya dibedakan berdasarkan jenis reaksi yang terlibat didalam proses titrasi. Ada berbaga macam metode titrasi, diantaranya adalah asidimetri dan alkalimetri.
Asidimetri merupakan titrasi yang menggunakan asam ata acid sebagai larutan standarnya, terhadap suatu larutan basa. Sedangkan alkalimetri merupakan titrasi yang menggunakan basa atau alkali sebaga larutan standarnya, terhadap suatu larutan yang bersifat asam. Dalam titrasi terdapat perhitungan volume yang diperlukan guna mencapai titik ekivalen. Dalam prakteknya titik ekivalen sukar diamati, karena merupakan titik akhir teoritis atau titik akhir stoikiometri. Hal ini diatasi dengan pemberian indikator asam-basa yang membantu sehingga titik akhir titrasi dapat diketahui. Titik akhir titrasi merupakan keadaan di mana penambahan satu tetes zat penitrasi (titran) akan menyebabkan perubahan warna indikator.
Pada percobaan akan dilakukan penetapan kadar HCl dengan menggunakan NaOH sebagai larutan standarnya. Oleh karena itu dilakukanlah prosedur titrasi alkalimetri ini.
C. Rumusan Masalah
Rumusan masalah dalam praktikum ini adalah :
- Bagaimana cara membuat larutan standar NaOH?
- Bagaimana standarisasi larutan NaOH?
- Bagaimana prosedur standarisasi?
- Berapa kadar CH3COOH yang diperoleh dari proses titrasi?
D. Tujuan Praktikum
Tujuan praktikum ini adalah :
- Mengetahui cara membuat larutan standar NaOH .
- Mengetahui standarisasi larutan NaOH.
- Mengetahui prosedur standarisasi.
- Mengetahui kadar CH3COOH yang diperoleh dari proses titrasi.
BAB II KAJIAN PUSTAKA
Asam dan basa didefenisikan oleh ahli kimia berabad-abad yang lalu dalam sifat-sifat larutan air mereka. Dalam pengertian ini suatu zat yang larutan airnya berasa asam, memerahkan lakmus biru,bereaksi dengan logam aktif untuk membentuk hidrogen, dan menetralkan basa. Dengan mengikuti pola yang serupa, suatu basa didefenisikan sebagai zat yang larutan airnya berasa pahit, melarutkan lakmus merah terasa licin sabun, dan menetralkan (Achmad, 1996).
Banyak cara untuk memahami tentang asam dan basa. Kita dapat mengartikan asam dan basa berdasarkan keniakan konsentrasi dari ion H+ dan OH-. Jika sebuah larutan didalamnya terdapat H+yang jumlah lebih besar dari ion OH-, maka kita dapat menyebutkan sebagai larutan asam. Begitu pula jika suatu larutan memiliki jumlah ion OH- yang lebih banyak dari pada jumlah ion H+, maka larutan itu dapat kita katakan sebagai larutan basa. Hasil pereaksian asam dan basa itu sendiri dapat membentuk suatu senyawa yang biasa disebut sebagai garam, dan reaksi antara ion H+ dan OH- nya membentuk air yang bersifat netral (Raymond, 2004).
Analisis volumetri atau volumetri adalah cabang kimia analitik di mana pengukuran volume adalah operasi utama dan terakhir. Dalam volumetri, reaktan diambil dalam bentuk larutan dan volume larutan standar (larutan yang diketahui konsentrasinya) yang diperlukan untuk bereaksi sepenuhnya, dengan volume larutan yang tidak diketahui (larutan yang konsentrasinya akan ditentukan).Konsentrasi dapat diketahui dengan menggunakan rumus Normalitas (Pahari,2006). Titrasi merupakan salah satu metode untuk menentukan konsentrasi suatu larutan dengan cara mereaksikan sejumlah volume larutan tersebut terhadap sejumlah volume larutan lain yang konsentrasinya sudah diketahui. Larutan yang konsentrasinya sudah diketahui disebut larutan baku. Titrasi yang melibatkan reaksi asam dan basa disebut titrasi asam-basa (Muchtaridi, 2006).
Menurut Rohman (2007), asidi-alkalmetri termasuk reaksi netralisasi yakni reaksi anatar ion hidrogen yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk menghasilkan air yang bersifat netral. Netralisasi juga dapat dikatakan sebagai reaksi antara pemberi proton (asam) dengan penerima proton (basa). Dalam metode titrimetri atau analisis volumetri atau analisis kuantitatif dengan mengukur volume sejumlah zat yang diselidiki direaksikan dengan larutan baku (standar) yang kadar (konsentrasiya) telah diketahui secara teliti dan reaksinya berlangsung secara kuantitatif. Suatu titrasi yang ideal adalah jika titik akhir titrasi sama dengan titik ekivalen teoritis. Dalam pernyataannya selalu ada perbedaan kecil. Beda ini disebutkan dengan kesalahan titrasi yang dinyatakan dengan mililiter larutan baku. Oleh karena itu pemilihan indikator harus dilakukan sedemikian rupa agar kesalahan in sekecil-kecilnya. Dalam larutan, kadar bahan yang terlarut (solut) dinyatakan dengan konsentrasi. Istilah ini berarti banyaknya massa yang terlarut dihitung sebagai berat (gram) tiap satuan volume (mililiter) atau tiap satuan larutan, sehingga satuan kadar seperti ini adalah gram/mililiter.
Dalam titrasi diperlukan larutan standar sebagai titrat. Larutan standar terbagi menjadi larutan standar primer dan larutan standar sekunder menurut Watson (2005), larutan standar primer adalah larutan yang mengandung senyawa kimia stabil yang tersedia dalam kemurnian tinggi dan dapat digunakan untuk menstandarisasi larutan standar yang digunakan di dalama titrasi. Contoh : asam oksalat, asam benzoat, kalium hidroge flatat, KBrO3. Larutan standar sekunder adalah larutan yang telah melalui proses standarisasi dan memiliki konsentrasi tertentu. Contoh : NaOH, HCl, AgNO3.
BAB III METODE PRAKTKUM
A. Waktu dan Tempat
Praktikum alkalimetri ini kami lakukan pada:
Hari:
Tempat:
B. Alat dan Bahan
Alat
- labu ukur 100 ml
- labu ukur 500 ml
- erlenmeyer 250 ml
- batang pengaduk
- kaca arloji
- neraca
- botol timbang
- pipet gondok
- pipet tetes
- buret 50 ml
- statif dan klem
- corong
Bahan
- NaOH
- CH3COOH
- H2C2O4.H2O
- indikator pp
- aquades
C. Prosedur Kerja atau Cara Kerja
a. Membuat larutan standar NaOH
- Timbang 4 gr NaOH, kemudian dilarutkan dengan aquades dalam labu ukur 500ml hingga tanda batas.
- Tutup labu ukur dan homogenkan.
b. Standarisasi larutan NaOH dengan H2C2O4.H2O
- Timbang 2,7 gr H2C2O4.H2O, kemudian dilarutkan dengan aquades dalam labu ukur 500 ml hingga tanda batas.
- Pipet 10 ml H2C2O4.H2O ke dalam erlenmeyer
- Tambahkan 3 tetes indikator pp, titrasi dengan NaOH hingga berubah warna, lakukan sebanyak 3 kali.
c. Penetapan kadar CH3COOH
- Masukkan 0,6 ml CH3COOH kedalam labu ukur 100ml, kemudian encerkan dengan aquades hingga tanda batas.
- Pipet 10 ml CH3COOH ke dalam erlenmeyer
- Tambahkan 3 tetes indikator pp, titrasi dengan NaOH hingga berubah warna, lakukan sebanyak 3 kali.
BAB IV HASIL DAN PEMBAHASAN
Adapun pembahasan dalam laporan praktikum alkalimetri ini adalah sebagai berikut :
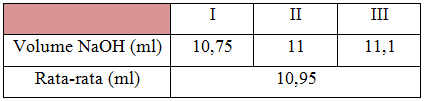
Pada percobaan alkalimetri ini, digunakan larutan NaOH sebagai larutan standar, namun karena NaOH merupakan larutan standar sekunder maka perlu distandarisasi. Asam oksalat (H2C2O4.H2O) 0,02 N sebagai larutan standar primer, untuk menstandarisasi larutan NaOH sehingga dapat diketahui konsentrasinya. Indikator yang digunakan adalah indikator pp. Sampel yang ditentukan kadarnya adalah senyawa asam lemah yaitu asam asetat (CH3COOH).
Untuk pembuatan larutan standar NaOH, dibutuhkan kristal NaOH sebanyak 4 gr dan aquades sebanyak 500 ml. Sedangkan untuk pembuatan larutan standar C2H2O4.H2O diperlukan krital asam oksalat sebanyak 2,7 gr. Kemudiian dilakukan standarisasi larutan NaOH dengan menggunakan larutan standar C2H2O4.H2O untuk menentukan konsentrasi NaOH. Proses standarisasi ini menggunakan indikator pp, sehingga setelah tercapai titik ekivalen didapat warna pink keunguan. Didapat konsentrasi NaOH sebesar 0,04 N. Dan NaOH dapat digunakan sebagai titrat CH3COOH.
Reaksi pada proses standarisasi larutan NaOH dengan asam oksalat :
H2C2O4.H2O(S) + 2NaOH(aq) → Na2C2O4 (aq) + 3H2O(l)
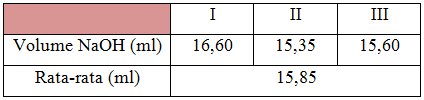
Pada saat pembuatan larutan sampel dilakukan di dalam lemari asam, hal ini bertujuan agar CH3COOH tidak terkontaminasi dengan udara atau bahan-bahan yang lainnya. Pada saat pengambilan asam asetat di lakukan dengan menggunakan pipet, sebanyak 10 mL. Pada saat memasukkan asam asetat kedalam labu ukur, sebaiknya gelas ukur di cuci dengan aquades agar kandungan asam asetat yang masih menempel ikut serta masuk kedalam labu ukur, kemudian hasil bilasannya di masukkan kedalam labu ukur. Kemudian dilakukan proses titrasi dengan menggunakan indikator pp sebanyak 3 tetes dan NaOH sebagai titrat setelah titik ekivalen tercapai didapat warna larutan menjadi pink keunguan. Untuk perhitungan kadar asam asetat digunakan rumus:
% (b/v) sampel = N x BM x (10/100) 100%
Dari perhitungan diperoleh kadar CH3COOH sebesar 38,04%. Reaksi dari proses titrasi alkalimetri ini adalah:
CH3COOH (aq) + NaOH(aq) → CH3COONa(aq) + H2O
Reaksi indikator pp ketika ditambahkan dengan NaOH:
46 NaOH + C20H14O4 → 46 Na + 20 H2CO2 + 10 H2O
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Achmad, H. (1996). Penuntun belajar kimia dasar: Kimia larutan. Bandung: PT. Citra Aditya Bakti.
- Chang, Raymond. 2004. Kimia Dasar Konsep-Konsep Inti Edisi Ketiga Jilid 1. Jakarta: Erlangga.
- Muchtaridi dan Justiana, Sandri. 2006. KIMIA 1. Jakarta. Yudhistira.
- Pahari, A.K, Chauhan, B S. 2006. Engineering Chemistry. New Delhi: Laxmi Publication
- Abdul Rohman. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar.
- Watson, D. G. 2005. Analisis Farmasi Edisi kedua. Jakarta : EGC Penerbit Buku Kedokteran
BAB V PENUTUP
Kesimpulan
- Pembuatan larutan standar NaOH dilakukan dengan cara melarutkan kristal NaOH dengan aquades, larutan NaOH kemudian distandarisasi terlebih dahulu dengan larutan standar primer asam oksalat agar dapat digunakan sebagai larutan standar, yang disebut larutan standar sekunder.
- Dari proses standarisasi NaOH dengan larutan asam oksalat diperoleh normalitas sebesar 0,04N.
- Dari percobaan titrasi alkalimetri diperoleh kadar CH3COOH sebesar 38,04%.
