Laporan Praktikum Kesetimbangan Kimia berikut ini merupakan laporan yang admin susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
Tujuan
[su_box title=”Tujuan Praktikum” box_color=”#000000″ title_color=”#ffffff”]
Praktikum kesetimbangan kimia ini bertujuan untuk menentukan besaran tetapan kesetimbangan reaksi kimia serta mengetahui pengaruh konsentrasi pada reaksi kesetimbangan.
[/su_box]
Latar Belakang
Kesetimbangan kimia merupakan proses yang dialami oleh larutan baik itu perubahan fisika larutan maupun perubahan kimia pada larutan. Perubahan fisika yang terjadi pada larutan seperti penguapan dan peleburan. Sementara perubahan kimia yang terjadi adalah elektrokimia.
Dalam reaksi kimia, indikator yang diamati seperti suhu, kadar zat yang ikut bereaksi, serta tekanan pada zat tersebut. Larutan disebut telah mengalami reaksi kesetimbangan apabila tidak ada lagi perubahan terhadap susunan kimia di dalam sistem larutan. Sehingga komposisi larutan tidak mengalami perubahan.
Untuk menggambarkan keadaan kesetimbangan secara kuantitatif, maka dituliskan kesetimbangan reaksi yang terjadi antara produk dan reaktan yang bergantung terhadap suhu lingkungan tempat reaksi berlangsung. Kesetimbangan kimia sendiri adalah topik utama dalam materi kimia fisik.
BAB II KAJIAN PUSTAKA
A. Pengertian Kesetimbangan Kimia
Ada banyak jenis reaksi kimia yang berlangsung tidak hingga selesai namun reaksi tersebut mendekati suatu kondisi kesetimbangan yang mana reaktan serta produk yang tidak terpakai saat reaksi, atau produk dan reaktan sisa, keduanya berada pada jumlah yang secara relatif tertentu banyaknya.
Saat reaksi kimia yang berlangsung mencapai kondisi kesetimbangan, maka tidak akan terjadi lagi perubahan terhadap komposisi. Menurut Oxtoby (2011), keadaan kesetimbangan dapat dituliskan secara kuantitatif menggunakan tetapan kesetimbangan reaksi yang dipengaruhi oleh suhu tempat terjadi reaksi.
Kesetimbangan kimia berlangsung pada suatu reaksi kimia yang memiliki sifat reversibel. Sifat reversibel adalah suatu reaksi yang dapat kembali ke wujud semula. Artinya pada suatu reaksi kesetimbangan kimia, produk hasil reaksi kimia dapat bereaksi kembali ke wujud reaktannya.
Kesetimbangan kimia akan tercapai apabila laju reaksi ketika maju sama besarnya dengan laju reaksi ketika balik. Syarat selanjutnya agar tercapai kesetimbangan kimia adalah konsentrasi produk serta reaktan tidak berubah. Sebagai gambaran persamaan reaksi reversibel sebagai berikut:
xA + yB ⇌ zC + hD
B. Konstanta Kesetimbangan
Konstanta kesetimbangan merupakan rasio perkalian antara konsentrasi reaktan pada reaksi kimia yang kemudian dibagi terhadap perkalian dari konsentrasi antara produk–produk reaksi kimia. Setiap konsentrasi dari reaktan dan juga produk reaksi kimia ini dipangkatkan terhadap koefisien stoikiometri.
Koefisien stoikiometri yang digunakan pada pangkat reaksi kimia kesetimbangan haruslah yang diperoleh ketika persamaan reaksi telah setara. Penulisan konstanta kesetimbangan umumnya menggunakan lambang K. Berikut adalah perhitungan persamaan pada reaksi setara:
[su_box title=”Rumus Kesetimbangan” box_color=”#ee3275″]

Keterangan:

[/su_box]
Apabila reaksi kimia yang diperhitungkan konstanta kesetimbangan reaksinya berada dalam fasa yang sama alias homogeny, maka perhitungan konsentrasi substansi pada sistem larutan dinyatakan menggunakan konsentrasi molar. Sehingga konsentrasi K bisa ditulis dalam bentuk Kc.
Sementara apabila reaksi kimia homogen yang terjadi berada dalam wujud gas, maka konsentrasi substansi dinyatakan dalam bentuk tekanan parsial substansi. Penulisan simbol konstanta kesetimbangan pun berubah menjadi Kp. Berikut adalah bentuk penulisan hukum kesetimbangan kimia wujud gas.
[su_box title=”Contoh Kesetimbangan Kimia” box_color=”#ee3275″]

Untuk mencari nilai konsentrasi substansi Kc maupun Kp, menggunakan rumus berikut ini:
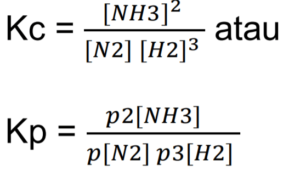
[/su_box]
C. Faktor yang Mempengaruhi Kesetimbangan Kimia
[su_box title=”4 Faktor Mempengaruhi Kesetimbangan” box_color=”#000000″ title_color=”#ffffff”]
1. Perubahan Konsentrasi
Konsentrasi yang berubah akan membuat posisi kesetimbangan juga berubah. Posisi kesetimbangan yang dimaksud adalah jumlah relative dari produk dan juga reaktan.
2. Perubahan Tekanan dan Volume
Tekanan dan volume yang berubah memiliki kemungkinan untuk mengubah kondisi sistem gas yang berada dalam kesetimbangan.
3. Perubahan Suhu
Perubahan suhu di dalam sistem reaksi kimia dapat mengubah nilai pada konstanta kesetimbangan.
4. Pemberian Katalis
Katalis memiliki fungsi untuk mempercepat tercapainya kondisi keadaan kesetimbangan. Pemberian katalis akan membuat laju reaksi maju dan laju reaksi balik semakin cepat. Namun, pemberian katalis tidak akan mengubah nilai konstanta kesetimbangan dan juga posisi kesetimbangan (Chang, 2003).
[/su_box]
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum kesetimbangan kimia ini kami lakukan pada:
Hari: Senin, 24 Oktober 2020
Tempat: Laboratorium Kimia SMAN 20
B. Alat dan Bahan
Berikut adalah alat serta bahan yang digunakan pada praktikum kesetimbangan kimia:
Alat
- Corong pisah sebanyak 2 buah
- Pipet tetes sebanyak 3 buah
- Buret berukuran 50 ml sebanyak 1 buah
- Labu Erlenmeyer sebanyak 3 buah
- Klem dan statif sebanyak dua pasang
- Pipet skala berukuran 5 ml serta 25 ml sebanyak masing-masing 1 buah
- Gelas ukur berukuran 25 ml serta 100 ml sebanyak masing-masing 1 buah
- Botol semprot sebanyak 1 buah
- Botol timbang sebanyak 1 buah
- Spatula sebanyak 1 buah
- Filter sebanyak 1 buah
- Batang untuk mengaduk sebanyak 1 buah
Bahan
- Larutan KI 0,1 M
- Larutan Iod jenuh dalam bentuk senyawa CHCl3
- Larutan Na-tiosulfat 0,02 M
- Larutan Amilum 1%
- Kristal KI
C. Prosedur Kerja atau Cara Kerja
Berikut ini merupakan prosedur kerja atau cara kerja dalam praktikum kesetimbangan kimia:
- Larutan Iod jenuh dalam bentuk senyawa CHCl3 sebanyak 30 ml dimasukkan ke dalam corong pisah 1 dan corong pisah 2.
- Corong pisah 1 diisi dengan air aquades sebanyak 100 ml.
- Corong pisah 2 diisi dengan larutan KI 0,1 M sebanyak 100 ml.
- Amati kondisi reaksi kimia yang terjadi hingga terbentuk larutan setimbang.
- Pada masing-masing corong pisah, ambil sebanyak 5 ml lapisan dietil eter kemudian lapisan tersebut dimasukkan ke dalam Erlenmeyer.
- Pada Erlenmeyer masukkan padatan KI sebanyak 2 gram serta air aquades sebanyak 20 ml. Selanjutnya larutan diguncang.
- Larutan kemudian dititrasi menggunakan larutan Na-tiosulfat 0,02 M.
- Lihat perubahan warna pada larutan. Larutan akan berubah warna menjadi biru
- Selanjutnya lihat kembali corong pisah 1 dan 2. Masing-masing diambil lapisan air sebanyak 50 ml.
- Amati warna lapisan air. Lapisan air akan berubah warna menjadi bening.
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan

B. Pembahasan
Reaksi yang terjadi pada praktikum kesetimbangan kimia di atas adalah:

Nilai di atas dapat dibulatkan ke atas menjadi 0,1 M
Tetapan Kesetimbangan (Kc)

Praktikum Kesetimbangan kimia di atas ditujukan untuk memperoleh nilai tetapan kesetimbangan reaksi I2. Untuk memperoleh nilai tetapan kesetimbangan reaksi, maka harus ditentukan dulu kelarutan iod pada pelarut.
Pelarut yang digunakan adalah KI 0,1 M serta air aquades. Penggoncangan campuran larutan I2 ke dalam air bertujuan agar iod terdistribusi sempurna dalam air tersebut dan terpisah ke dalam dua jenis fasa yaitu fasa non polar dan polar.
Berdasarkan pengamatan yang dilakukan, dapat dilihat bahwa terbentuk dua jenis lapisan pada larutan yaitu lapisan CHCI3 dan air. Hal ini dikarenakan air serta larutan CHCI3 tidak bersifat saling melarutkan karena CHCI3 bersifat nonpolar sementara air polar.
Kedua jenis larutan ini akan tercampur sesaat saja. Namun ketika didiamkan, maka keduanya akan terpisah. Larutan CHCI3 yang bersifat nonpolar memiliki massa jenis lebih besar ketimbang air yang polar. Sehingga larutan CHCI3 berada di bawah lapisan air.
Sementara pada corong kedua, larutan ditambahkan dengan KI 0,1 M. Setelah campuran larutan digoncang dan didiamkan selama beberapa saat, ternyata larutan KI terlarut dalam air. Senyawa iod dalam KI akan membentuk ion yang kompleks yaitu triyodida.
Penambahan Kristal KI pada larutan bertujuan agar pengeluaran I2 yang terlarut di dalam larutan CHCI3 lebih mudah. Penggunaan Na2S2O3 sebanyak 0,02 M bertujuan untuk membakukan nilai senyawa iod yang mudah menguap. Penambahan Na2S2O3 dilakukan melalui proses titrasi.
Berdasarkan perhitungan, diperoleh nilai I2 bebas sebesar 0,0377 x M. Sementara konsentrasi iod yang tidak bebas berbentuk I3 bernilai sebesar 0,142 x
M. Perhitungan keduanya menghasilkan konsentrasi setimbang 0,1 M.
Sehingga tetapan kesetimbangan I2 sebesar 7,115.
BAB V PENUTUP
Kesimpulan
Kesimpulan yang bisa diambil dari praktikum kesetimbangan kimia adalah:
- Iodine atau Iod sulit untuk terlarut di dalam air karena sifatnya yang nonpolar sementara air bersifat polar. Larutan CHCI3 yang bersifat nonpolar berada di lapisan bawah sementara air yang bersifat polar berada di lapisan atas.
- Pada praktikum ditemukan bahwa iod mudah terlarut dalam KI sehingga tetapan kesetimbangan antara KI dan iod sebanyak 7,115.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Chang, Raymond. 2009.Chemistry 10th Edition. New York: Mc-Graw Hill.
- Oxtoby, dkk. 2005. Prinsip-Prinsip Kimia Modern Jilid 1. Jakarta: Erlangga.
Download Laporan Praktikum (PDF)
Anda Dapat Mendownload laporan praktikum kesetimbangan kimia ini dalam format PDF dengan mengklik tombol download dibawah ini.
[su_spoiler title=”Download / Unduh” style=”fancy” icon=”chevron-circle”]
Download File
PDF (144KB)[/su_spoiler]
