Atom memiliki struktur terluar yaitu kulit atom. Kulit tersebut ternyata masih memiliki subkulit dimana subkulit tersebut terdapat orbital yaitu tempat ditemukannya elektron. Untuk menentukan nilai dari keberadaan elektron maka diperlukan adanya suatu bilangan yang disebut sebagai bilangan kuantum.
Sebelum kalian belajar mengenai konfigurasi elektron, kalian pasti akan menemui materi pembelajaran mengenai bilangan kuantum bukan? Apa yang disebut dengan bilangan kuantum itu? Untuk informasi lebih lengkapnya, simak penjelasan berikut ini!
Pengertian Bilangan Kuantum
Bilangan kuantum merupakan suatu bilangan berupa nilai yang menyatakan kedudukan elektron serta dapat memberikan gambaran mengenai sifat atom dalam orbital. Penemuan bilangan kuantum didasarkan pada teori mekanika kuantum yang dikemukakan oleh seorang ilmuwan bernama Erwin Schődinger.
Teori mekanika kuantum menjelaskan bahwa untuk menggambarkan distribusi atau model persebaran elektron di luar inti atom diperlukan suatu bilangan yang disebut sebagai bilangan kuantum. Kalian dapat menganalogikan kedudukan elektron di setiap orbital atau kulit atom adalah planet-planet penghuni tata surya.
Setiap orbital tentu ada jarak yang berupa tingkat energi, variasi bentuk orbital, orientasi orbital, dan spin orbital. Keempat sifat tersebut dapat dinyatakan nilainya menggunakan bilangan kuantum.
Terdapat perbedaan antara teori yang dikemukakan oleh Niels Bohr dengan teori mekanika kuantum. Teori atom Bohr menyatakan bahwa atom hanya memiliki kulit saja yang dinyatakan dalam K, L, M, N, dst saja. Selama elektron mengelilingi inti atom, energi yang dibutuhkan bersifat stasioner atau kontinyu.
Energi tersebut digunakan oleh elektron untuk melakukan pergerakan, tetapi tidak berkurang. Energi ini disebut lintasan elektron atau kulit elektron. Bohr juga menjelaskan bahwa elektron dapat berpindah dari tingkat energi rendah menuju tingkat energi yang lebih tinggi atau istilahnya disebut ekstasi.
Namun sebaliknya, jika elektron bergerak dari tingkat energi tinggi menuju rendah atau dari kulit luar menuju dalam disebut de-ekstasi. Teori atom Bohr hanya menjelaskan atom sampai pada kulitnya, sehingga kemudian lahirlah teori mekanika kuantum.
Teori tersebut menyatakan bahwa masing-masing kulit atom masih terdapat subkulit atom. Setiap subkulit memiliki orbital tertentu.
Macam-macam bilangan kuantum
Bilangan kuantum ini ada 4 jenis, lho! Apa saja jenis-jenis dari bilangan kuantum? Mari simak penjelasan berikut ini!
1. Bilangan kuantum utama
Bilangan kuantum utama berfungsi untuk menyatakan posisi atom pada bagian kulit atau disebut juga sebagai tingkat energi utama. Bilangan ini disimbolkan dengan huruf “n”. Dalam bilangan kuantum utama dapat diketahui jarak rata-rata elektron dari inti atom.
Bilangan kuantum utama bernilai positif, sehingga tidak memiliki nilai nol. Penulisannya pun dimulai dengan angka 1, 2, 3, 4, dan seterusnya mewakili tiap kulit K, L, M, dan N. Jika semakin besar nilai suatu bilangan kuantum utama, maka jarak rata-rata elektron tersebut dengan inti atom semakin jauh.
Contoh penulisannya adalah sebagai berikut.
Jika n = 1 maka elektron berada di kulit K atau kulit pertama
Jika n = 2 maka elektron berada di kulit L atau kulit kedua
Jika n = 3 maka elektron berada di kulit M atau kulit ketiga
Jika n = 4 maka elektron berada di kulit N atau kulit keempat, begitupun seterusnya.
2. Bilangan kuantum azimut/momentum sudut
Sering disebut juga dengan nama bilangan kuantum anguler (sudut). Bilangan kuantum azimut berfungsi untuk menyatakan jumlah subkulit atom yang mana di dalamnya akan terdapat orbital-orbital. Kuantum azimut disimbolkan menggunakan huruf “l”. Besarnya nilai kuantum azimut dinyatakan dengan rumus (n-1).
Setiap nilai bilangan kuantum azimut dapat ditulis dalam huruf historis yaitu s, p, d, f mewakili bilangan 0, 1, 2, 3. Untuk s (sharp) dapat diisi oleh 2 elektron, p (principal) diisi oleh 6, d (diffuse) diisi oleh 10 elektron, dan f (fundamental) diisi oleh 14 elektron. Contoh penulisannya adalah sebagai berikut.
Kulit pertama (K) nilainya 0 memiliki 1 subkulit (s) dengan jumlah elektron maksimal 2.
Kulit kedua (L) nilainya 1 memiliki 2 subkulit (s,p) dengan jumlah elektron maksimal 8.
Kulit ketiga (M) nilainya 2 memiliki 3 subkulit (s,p,d) dengan jumlah elektron maksimal 18.
Kulit keempat (N) nilainya 3 memiliki 4 subkulit (s,p,d,f) dengan jumlah elektron maksimal 32.
3. Bilangan kuantum magnetik
Dalam subkulit atom, masing-masing dari subkulit memiliki orbital yang berbeda-beda. Untuk menyatakan bentuk orbital itu, digunakan suatu bilangan yang disebut bilangan kuantum magnetik. Simbol dari bilangan kuantum magnetik dinyatakan dalam bentuk huruf “m”.
Besarnya bilangan kuantum magnetik berkisar –1 dari +1 termasuk 0. Setiap orbital dalam bilangan kuantum magnetik biasanya ditulis dengan simbol kotak dengan panah di dalamnya. Panah tersebut akan menentukan besarnya bilangan kuantum spin. Contoh penulisannya adalah sebagai berikut.
Subkulit s nilainya adalah 0 memiliki 1 orbital
Subkulit p nilainya adalah -1, 0, +1 memiliki 3 orbita.
Subkulit d nilainya adalah -2, -1, 0, +1, +2 memiliki 5 orbital
Subkulit f nilainya adalah -3, -2, -1, 0, +1, +2, +3 memiliki 7 orbital
4. Bilangan kuantum spin
Bilangan kuantum spin digunakan untuk menyatakan kemana arah rotasi pergerakan suatu elektron. Melalui bilangan ini dapat diketahui pula energi dan bentuk orbital. Bilangan kuantum spin dilambangkan dengan simbol huruf “s”.
Bilangan kuantum ini menggambarkan keadaan elektron yang sudah benar-benar kuantum. Bagaimana cara mengetahui nilai bilangan kuantum spin? Bilangan kuantum spin terlepas dari pengaruh momentum sudut dan tidak berhubungan dengan ketiga bilangan kuantum sebelumnya.
Penyelesainnya tidak didasarkan pada persamaan gelombang, melainkan didasarkan pada pengamatan spektrum yang dilewatkan medan magnet oleh Otto Stern dan Walter Gerlach. Dalam pengamatannya terdapat hasil berupa 2 spektrum yang terpisah, tetapi memiliki kerapatan yang sama.
Dari pengamatan tersebut dapat disimpulkan bahwa terjadi adanya pemisahan garis spektrum akibat dari medan magnet. Hal ini disebabkan lantaran elektron tersebut berputar mengelilingi inti atom dengan arah yang berbeda.
Besarnya bilangan kuantum spin adalah +1/2 jika arah rotasinya sejajar dengan jarum jam dan jika arah rotasinya berlawanan maka nilainya -1/2. Bilangan kuantum spin dapat diketahui dengan melihat arah anak panah yang terdapat dalam kotak bilangan kuantum magnetik.
Apabila arah anak panah ke atas maka nilainya +1/2, namun jika arah anak panah ke bawah maka nilainya -1/2. Adapun cara menuliskan bilangan kuantum yaitu sebagai berikut. Misalnya, diketahui :
- Bilangan kuantum utama n= 2
- Bilangan kuantum azimut l= 2 (p) memiliki 3 orbital
- Bilangan kuantum magnetik m= -1, 0, +1 dengan masing-masing memiliki 2 bilangan spin, sehingga jumlahnya ada 6 bilangan spin.
Maka penulisannya menjadi 2p6.
Untuk memudahkan kalian dalam memahami keempat bilangan kuantum, maka perhatikan tabel bilangan kuantum dibawah ini.
Penulisan bilangan kuantum yang demikian digunakan dalam menentukan konfigurasi elektron subkulit. Untuk membuat susunan konfigurasi elektron ada beberapa aturan yang harus kalian ketahui. Apa saja itu?
Aturan pendistribusian elektron
Konfigurasi elektron juga dikenal sebagai aturan pendistribusian elektron. Bilangan kuantum yang sudah kalian pelajari sebelumnya dapat kalian gunakan untuk menuliskan diagram konfigurasi elektron sesuai prinsip Aufbau.
Susunan elektron dapat digambarkan menggunakan konfigurasi elektron. Sebagai contoh, walaupun sama-sama dari subkulit 1s, tetapi tingkat energi subkulit 1s atom natrium tidak sama dengan tingkat energi subkulit 1s atom magnesium.
Untuk mengetahui aturan yang digunakan dalam menentukan konfigurasi elektron, mari simak penjelasan berikut!
1. Prinsip Aufbau
Arti dari Aufbau adalah membangun, maka prinsip aufbau menjelaskan bahwa elektron dalam suatu atom memiliki kondisi yang stabil apabila berada dalam tingkat energi rendah atau kulit pertama. Kemudian elektron yang berada di dalam setiap orbital akan membentuk subkulit.
Jadi, elektron mempunyai kemampuan atau kecenderungan untuk menempati subkulit yang memiliki tingkat energi rendah. Pengisian elektron dimulai dari orbital dengan tingkat energi rendah menuju tingkat energi yang lebih tinggi. Aturan tingkat energi elektron pada asas aufbau ini sesuai dengan diagram berikut.
(Ilustrasi: nawikimia.com)
Penulisannya dapat ditulis dengan menggunakan lambang unsur kimia agar lebih singkat. Misalnya :
1s2 ditulis [He]2
2s2 2p6 ditulis [Ne]10
3s2 3p6 ditulis [Ar]18
4s2 3d10 4p6 ditulis [Kr]36
5s2 4d10 5p6 ditulis [Xe]54
6s2 4f14 5d10 6o6 ditulis [Rn]86
7s2 5f14 6d10 7p6 ditulis [Og]118
2. Aturan Hund
Untuk orbital-orbital yang memiliki tingkat energi sama, tiap orbital akan terlebih dahulu terisi dengan sebuah elektron yang memiliki spin yang sama (1/2 penuh). Kemudian, barulah orbital-orbital tersebut saling berpasangan atau penuh.
3. Elektron Valensi
Elektron valensi merupakan sejumlah elektron yang terletak di bagian subkulit terluar dari sebuah atom yang dapat digunakan untuk membentuk ikatan kimia.
Elektron valensi ini dapat ditentukan dengan menggunakan konfigurasi elektron. Misalkan, Sebuah atom oksigen dengan nomor atom 8, maka konfigurasi elektronnya adalah 2, 6, maka elektron valensinya adalah 6.
4. Diagram Orbital
Dalam satu orbital memiliki elektron maksimum sebanyak 2 elektron dengan muatan keduanya adalah negatif, sehingga menyebabkan keduanya saling tolak-menolak. Gaya tolak–menolak ini diimbangi oleh adanya rotasi yang arahnya saling berlawanan.
Maka dari itu, suatu diagram orbital akan dilambangkan sebagai dua anak panah yang saling berlawanan . Nilai pada diagram orbital ini dapat dinyatakan dengan menggunakan bilangan kuantum spin.
Jika di dalam sebuah soal diketahui sebuah atom dengan nomor massanya dan kalian diminta untuk menentukan keempat bilangan kuantumnya, maka kalian dapat memahami melalui contoh soal berikut ini. Misalnya, diketahui:
Sebuah atom aluminium memiliki nomor atom yaitu 13 (Al13), tentukan susunan konfigurasi elektronnya!
Penyelesaian :
Pertama yang harus kalian lakukan adalah membuat diagram berdasarkan prinsip Aufbau. Selanjutnya, ingat kembali jumlah elektron maksimal pada setiap subkulit s, p, d, f. Setelah itu, kalian dapat menentukan konfigurasinya dengan mengurutkan susunan 1s2 2s2 2p6 3s2 3p1. Bagaimana? Mudah, bukan?
Orbital
Sebelumnya kalian telah mengenal subkulit atom yang dinyatakan menggunakan bilangan kuantum azimut. Lalu, pada tiap-tiap subkulit memiliki orbital. Apa sebenarnya arti dari orbital itu?
Kalian dapat menganalogikannya seperti sebuah lintasan yang dilalui oleh elektron-elektron. Lintasan itu berupa ruangan diantara dimana di dalamnya terdapat kecenderungan ditemukannya elektron.
Setiap orbital memiliki ukuran, bentuk, dan arah orientasi yang berbeda-beda. Perbedaan itu dipengaruhi oleh ketiga bilangan kuantum, yaitu bilangan kuantum utama, azimut, dan spin.
Orbital yang saling bertemu akan membentuk suatu kumpulan yang dinamakan subkulit. Subkulit tersebut akan bergabung, kemudian membentuk kulit dengan tingkat energi utama. Ketiganya akan saling berkaitan satu sama lain. Berikut ini adalah macam-macam orbital pada tiap masing-masing subkulit.
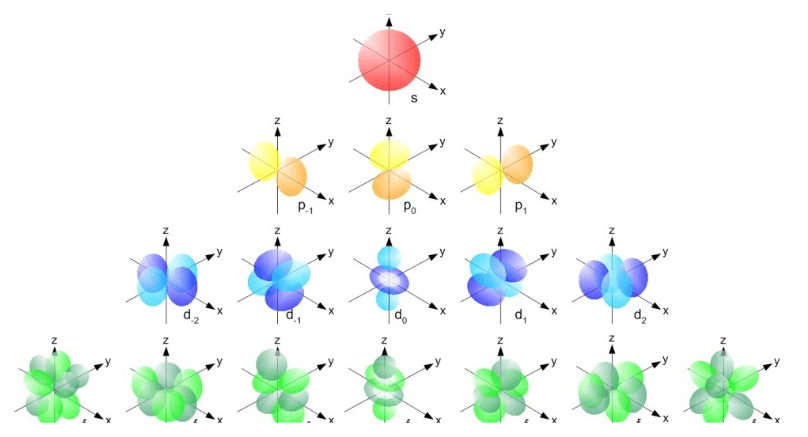
1. Orbital subkulit s
Memiliki susunan dari bilangan kuantum azimut l=0 dan mempunyai ukuran yang berbeda. Tergantung besarnya nilai bilangan kuantum utama n pada bagian kulit yang mana.
Di dalam subkulit s terdapat banyak kemungkinan ditemukannya elektron. Akibatnya, orbital ini memiliki bentuk seperti bola.
2. Orbital subkulit p
Bilangan kuantum azimut subkulit p adalah l=1, maka subkulit p tersusun atas 3 macam orbital. Dimana orbital di dalam subkulit p terbagi menjadi 3 jenis, yaitu Px, Py, dan Pz. Orbital subkulit p digambarkan dalam bentuk seperti dumbell. Kemungkinan didalamnya mulai jarang ditemukan elektron.
3. Orbital subkulit d
Orbital subkulit d memiliki bilangan kuantum azimut, yaitu l=2 dan tersusun atas lima orbital. Arah orientasi dari orbital d dibedakan menjadi 2 jenis. Pertama, arah orientasi yang berada di antara sumbu yang terdiri dari 3 orbital (dxy, dxz, dyz). Kedua, yaitu yang berada pada sumbu terdiri atas 2 orbital (dx2-y2 dan dz2).
4. Orbital subkulit f
Subkulit f tersusun atas 7 macam orbital dengan energi yang setara atau sama. Orbital jenis ini digunakan oleh unsur transisi yang memiliki letak lebih dalam. Bentuk dari orbital f yang lebih rumit dan kompleks ini terbagi atas 3 kelompok, yaitu:
- Kelompok 1 : fxyz
- Kelompok 2 : fx(z2-y2), fy(z2-x2), fz(x2-y2)
- Kelompok 3 : fx3, fy3, fz2
Dalam orbital f terdapat kemungkinan tidak ditemukan adanya elektron yang dinamakan simpul.
Untuk bilangan kuantum magnetik terdapat orbital dengan 4 jenis berdasarkan subkulitnya. Sebagai referensi agar kalian lebih mudah mempelajari tentang bilangan kuantum, kalian dapat menonton video di bawah ini.
Bagaimana sudah mengertikah kalian mengenai bilangan kuantum? Mungkin masih tersirat banyak pertanyaan mengenai bilangan kuantum di benak kalian. Seperti, misalnya: (Lihat di FAQ)
FAQ
Kesimpulan
Kesimpulannya, bilangan kuantum merupakan bilangan yang digunakan untuk menyatakan nilai kedudukan elektron pada kulit atom. Nilai tersebut dapat menentukan jarak atau tingkat energi, jumlah subkulit, orbital, dan arah pergerakan orbital. Bilangan kuantum terbagi menjadi 4 jenis yaitu kuantum utama, azimut, magnetik, dan spin.