Bagi kalian yang ingin memulai belajar Kimia, sebagai langkah awal kalian wajib mengetahui dan memahami pengertian struktur atom. Atom dikenal sebagai satuan paling kecil dari suatu materi. Meskipun demikian, atom tersusun atas berbagai macam partikel subatomik. Susunan dari partikel subatomik inilah yang disebut dengan struktur atom.
Dalam materi pembelajaran Kimia, struktur atom terbagi menjadi 5 sub materi. Apa saja itu? Mari simak beberapa uraian dibawah ini!
Struktur Atom Berdasarkan Teori Tokoh
Struktur atom terbagi atas 3 jenis yaitu proton, neutron, dan elektron. Sebelum kalian mengenal lebih lanjut mengenai 3 jenis partikel tersebut, perlu kalian pahami struktur atom menurut para ahli dalam teori atom sebagai berikut.
1. Struktur atom berdasarkan teori Dalton
Teori atom Dalton yang dikemukakan oleh John Dalton menjelaskan bahwa atom merupakan bagian terkecil suatu materi dan tidak dapat terbagi lagi. Atom juga disebut sebagai bola pejal padat.
Perbedaan antara 2 jenis atom sejenis dan tidak sejenis dilihat dari sifat dan ukurannya. Dalton mengungkapkan bahwa atom adalah sesuatu yang tidak dapat dimusnahkan dan diciptakan.
Teori Dalton memiliki kelebihan dikarenakan dapat menjelaskan mengenai teori kekekalan massa. Dalam teorinya itu, ia mengungkapkan bahwa atom adalah sesuatu yang tidak dapat diciptakan dan dimusnahkan. Namun, atom dapat saling direaksikan sehingga membentuk zat baru yang disebut molekul senyawa.
Dalam teori Dalton, atom yang sedang mengalami reaksi kimia dapat terjadi penggabungan dan pemisahan atom. Teori atom Dalton juga mengungkapkan bahwa atom dapat bergabung membentuk molekul, yaitu kumpulan dua atau lebih dari atom yang saling berikatan karena ikatan kimia.
Teori atom Dalton merupakan teori sederhana dari atom di mana pada teori tersebut dijelaskan bahwa atom sudah tidak dapat terbagi lagi. Dapat disimpulkan bahwa atom sudah tidak memiliki struktur yang menyusunnya.
2. Struktur atom berdasarkan teori Thomson
Namun seiring berkembangnya zaman, teori atom mengalami penyempurnaan bentuk. Teori tersebut dikemukakan oleh Sir Joseph Thomson. Teorinya dikenal sebagai teori atom Thomson.
Teori Thomson menjelaskan bahwa atom adalah sebuah bola bermuatan positif yang didalamnya tersebar banyak partikel negatif yaitu elektron. Teorinya ini sering disebut sebagai teori roti kismis.
3. Struktur atom berdasarkan teori Rutherford
Teori yang dikemukakan Thomson masih belum sempurna. Oleh karena itu, munculah teori atom Rutherford oleh Ernest Rutherford. Teori ini menjelaskan bahwa atom merupakan bola bermuatan positif yang dikelilingi oleh elektron bermuatan negatif, sehingga bentuknya menyerupai tata surya.
Atom yang dikemukakan oleh Rutherford memiliki sifat netral karena jumlah antara proton dan elektronnya sama. Dalam teorinya, Rutherford juga menjelaskan terbentuknya gaya sentripetal akibat gaya tarik antara elektron dengan inti atom (gaya Coulomb).
Namun, teori atom Rutherford memiliki kelemahan. Teori tersebut bertolak belakang dengan teori gelombang elektromagnetik Maxwell.
Teori milik Rutherford juga belum mampu menjelaskan tentang keberadaan partikel elektron dan cara rotasinya. Pada teori ini juga tidak menjelaskan bagaimana proses terjadinya spektrum garis atom hidrogen.
4. Struktur atom menurut teori Bohr
Kesalahan teori Rutherford dibenahi oleh Niels Bohr dalam teorinya yang dikenal sebagai teori atom Bohr. Dalam teorinya, Bohr menjelaskan bahwa elektron yang bergerak mengelilingi inti atom memiliki suatu orbit tertentu. Selama dalam lintasan orbit tersebut elektron tidak mengalami perubahan energi.
Lintasan yang dilalui elektron merupakan lintasan stasioner yang memiliki momentum sudut kelipatan dihitung dari rumus h/2 . Teori atom Bohr sudah mendekati kata sempurna karena sudah menjelaskan mengenai pergerakan elektron yang mengelilingi inti atom.
Dalam perkembangannya, teori atom Bohr juga masih memiliki kesalahan. Kesalahan itu terletak pada ketidakmampuannya untuk menjelaskan bagaimana terbentuknya spektrum dari atom-atom yang berelektron banyak. Kemudian, lahirlah sebuah teori baru yang dikenal dengan Teori Mekanika Kuantum.
5. Struktur atom menurut teori mekanika kuantum
Teori mekanika kuantum dikemukakan oleh Werner Heisenberg dan Erwin Schrodinger. Teori ini menjelaskan bahwa momentum dan kedudukan suatu elektron tidak dapat ditentukan secara seksama.
Kalian hanya dapat menentukan kebolehjadian untuk menemukan elektron yang memiliki jarak tertentu dengan inti atom. Nah, teori ini kemudian dikenal sebagai asas ketidakpastian.
Nah, penjelasan diatas dapat memberikan gambaran pada kalian mengenai bentuk model atom, sehingga kalian dapat membayangkan bagaimana struktur atom itu.
Pengertian Struktur Atom
Lanjut ke dalam pengertian sesungguhnya, struktur atom adalah satuan dasar materi yang terdiri dari inti atom yang bermuatan positif dan dikelilingi oleh elektron bermuatan negatif. Pengertian struktur atom tersebut didasarkan pada teori milik Rutherford.
Elektron bergerak mengelilingi inti atom yang tersusun atas proton dan neutron. Gerakan ini dipengaruhi karena adanya gaya elektromagnetik yaitu gaya tarik antar partikel yang bermuatan listrik. Berikut adalah tabel struktur atom pada sistem periodik unsur.
(Ilustrasi: klik-kami.blogspot.com)
Partikel subatomik yang Menyusun Atom
Sebelumnya, di bagian awal kalian telah mengenal 3 jenis partikel penyusun atom. Masih ingatkah? Apa saja partikel-partikel yang menyusun atom itu?
1. Proton
Proton merupakan partikel subatomik penyusun atom yang memiliki muatan positif. Dilambangkan dengan huruf p+ atau p. Proton ditemukan oleh Eugene Goldstein pada tahun 1886 melalui percobaan tabung sinar katode sebagai perkembangan dari eksperimen Thomson.
Goldstein menambahkan pelat katode yang telah dilubangi ke dalam tabung katode. Tabung tersebut kemudian diisi dengan gas hidrogen bertekanan rendah. Ketika sinar katode merambat menuju anode, terdapat sinar lain yang bergerak berlawanan melalui plat katode berlubang yang disebut dengan sinar proton.
Proton memiliki massa yang lebih kecil dibandingkan dengan neutron, sehingga beratnya lebih ringan daripada neutron. Suatu atom yang memiliki jumlah proton lebih banyak daripada jumlah elektronnya, maka muatannya akan menjadi positif.
2. Neutron
Neutron adalah partikel subatomik yang tidak memiliki muatan atau disebut netral. Dilambangkan dengan huruf n0. Eksperimen untuk membuktikan neutron pertama kali dilakukan oleh W.Bothe dan H.Becker pada tahun 1930. Kedua ilmuwan tersebut menembaki inti atom berilium menggunakan partikel alfa.
Dari penembakan tersebut dihasilkan sebuah radiasi partikel yang memiliki kemampuan menembus sangat tinggi. Lalu pada tahun 1932, seorang ilmuwan bernama James Chadwick melakukan eksperimen yang sama dan menunjukan bukti bahwa penembakan partikel alfa menghasilkan sinar yang tidak bermuatan.
Pembuktiannya dilakukan dengan menempatkan materi padat yang mengandung banyak atom hidrogen. Contohnya seperti parafin sehingga dapat berfungsi sebagai penghalang. Parafin itu menyebabkan radiasi tidak bermuatan yang mengakibatkan proton dalam inti atom terlempar keluar.
Chadwick pun menyimpulkan bahwa partikel netral tersebut memiliki massa yang hampir sama dengan proton yang dinamakan neutron. Massa neutron cenderung lebih besar daripada massa proton, sehingga ditarik kesimpulan bahwa neutron lebih berat daripada proton.
3. Elektron
Elektron merupakan partikel penyusun atom yang memiliki muatan negatif. Dilambangkan dengan huruf e– atau e. Elektron ditemukan oleh Thomson pada tahun 1897 setelah ia mengamati kejadian pada dua pelat elektrode di dalam tabung vakum katode dalam percobaan struktur atom sebelumnya.
Thomson dikenal sebagai penemu elektron melalui percobaan tabung katode yang ditemukan oleh William Crookes. Di dalam tabung tersebut, sinar katode bersifat negatif dan bergerak menuju ke arah pelat bermuatan positif akibat adanya gaya tarik. Kejadian tersebut membuat Thomson berasumsi bahwa sinar yang belok ke arah sumbu positif tersebut adalah berkas elektron.
Elektron bergerak mengelilingi inti atom dengan susunan tertentu. Susunan elektron yang bergerak sesuai orbital ini dinamakan konfigurasi elektron. Dalam konfigurasi elektron dikenal istilah elektron valensi yang menyatakan banyaknya elektron yang berada di kulit terluar atom.
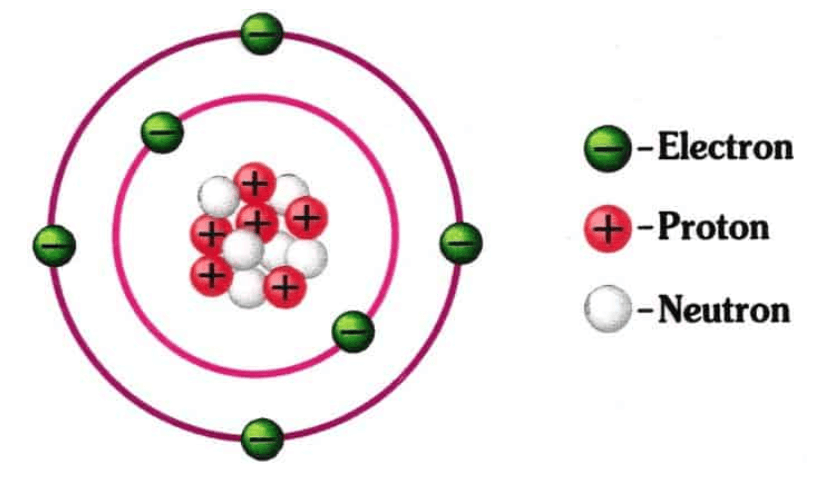
Untuk lebih memahami mengenai struktur atom, dapat kalian perhatikan gambar berikut!
(Ilustrasi: enjiner.com)
Cara Menentukan Massa atom
Atom merupakan suatu materi yang tentu memiliki massa. Massa pada atom ditentukan oleh massa intinya, karena hampir 99,97% massa atom adalah massa inti. Meskipun demikian, volume ruang yang ditempati oleh inti atom tidak luas yaitu sekitar 1×10-15 dari volume atom.
Sementara itu, diameter sebuah atom berukuran 100.000 kali diameter intinya. Nilai massa atom dan partikel subatomik sangat kecil dikarenakan ukuran massa atom yang relatif kecil. Oleh sebab itu, massa atom hanya dapat diukur dengan alat bernama spektrometer massa.
Alat tersebut bukan merupakan sebuah neraca, tetapi alat khusus hasil rekayasa teknologi yang digunakan untuk mengetahui massa partikel yang sangat kecil. Massa pada atom inilah yang dikenal sebagai massa atom relatif.
Alat pengukur partikel ini bekerja dengan menghasilkan sebuah kurva. Melalui kurva tersebut dapat diketahui jumlah massa dan persentase kelimpahan isotop di alam. Menghitung massa atom sama halnya seperti membandingkan suatu massa benda dengan massa benda lain.
Sementara itu, massa standar merupakan massa dari benda pembanding. Sebagai contoh, ketika kalian mencoba menimbang satu kilogram beras dengan anak timbangan yang bermassa 1 kilogram, maka anak timbangan itu disebut sebagai massa standar.
Dasar yang digunakan mengukur massa atom relatif adalah atom karbon yang memiliki 6 neutron dan 6 proton dan. Dengan begitu, dapat dinyatakan bahwa massa untuk satu atom C-12 senilai dengan 12 dalton (Da) atau 12 satuan massa atom (sma). Dapat juga dinyatakan dalam satuan massa atom hidrogen yang disebut 1 sma.
1 sma = 1,660539×10-24gram
Massa atom relatif ditulis dengan notasi Ar dan dirumuskan sebagai berikut.
ArX =massa rata-rata 1 atom X1/12 x massa 1 atom C-12
Massa atom relatif tidak memiliki satuan khusus.
Untuk mempermudah kalian memahami rumus menentukan Ar, kalian dapat memahami contoh soal berikut ini!
Massa rata-rata 1 atom N adalah 14 sma, hitunglah massa atom relatif N!
Penyelesaiannya adalah sebagai berikut.
Ar N=14 sma1/12 x 12 sma= 14
Jadi, massa atom relatif 1 atom N adalah 14.
Penulisan Notasi Unsur
Kalian sudah mengenal komponen penyusun atom dan massanya, maka selanjutnya kalian juga perlu mengetahui metode penulisannya. Dalam penulisan nomor massa dan nomor atom dikenal sebagai notasi unsur. Penulisannya pun ada rumusnya, lho.
Rumus penulisan notasi unsur adalah sebagai berikut.
XZA
Simbol “X” merupakan nama unsur, simbol “A” adalah nomor massa, sedangkan “Z” merupakan nomor atom yaitu jumlah proton atau elektron. Untuk menentukan jumlah neutron caranya adalah dengan mengurangkan nomer massa dengan nomor atom.
Jumlah neutron = Nomor massa – Nomor atom
Setelah kalian memahami cara menuliskan nomor massa dan nomor atom, maka kalian dapat menentukan jenis kumpulan dua atom atau lebih. Kumpulan dari atom-atom yang memiliki kesamaan tertentu disebut sebagai deret isotop, isoton, dan isobar.
Pengertian Deret Isotop, Isoton, dan Isobar
Berikut penjelasan mengenai tiga deret tersebut, simak baik-baik ya!
1. Isotop
Isotop yaitu sekumpulan atom yang memiliki kesamaan nomor atom, tetapi nomor massanya berbeda. Keadaan ini disebabkan karena perbedaan jumlah neutron. Contoh deretan isotop adalah C612,C613, dan C614.
Atom di atas merupakan atom karbon (Z=6) dengan 6 neutron dan 6 proton. Namun ketersediaannya di alam hanya 98,89%. Itu artinya, sisa 1,11% atom memiliki neutron sebanyak 7 (A=13) dan neutron sebanyak 8 (A=14). Akibatnya, atom karbon memiliki 3 isotop yaitu 12C, 13C, dan 14C.
Unsur-unsur yang ada di alam semesta ini merupakan gabungan dari banyak isotop, dapat dianalogikan seperti seseorang yang kembar namun tidak seiras. Keduanya memiliki nama yang sama namun berbeda massanya.
Untuk menghitungnya, kalian perlu mengetahui massa atom rata-ratanya, yaitu rata-rata dari massa isotop unsur yang diukur berdasarkan kelimpahannya di alam. Dengan begitu, dapat disimpulkan bahwa massa atom merupakan massa rata-rata dari keseluruhan isotop atom di alam.
Untuk menentukan massa atom rata-rata, kalian dapat menggunakan rumus berikut ini.
Massa atom rata-rata =[(massa isotop) x (kelimpahan atom)]
Massa atom rata-rata =m1a1+ m2a2 + m3a3 + …100 % ketersediaan isotop di alam
Agar kalian dapat memahami rumus tersebut, maka kalian dapat memperhatikan contoh soal perhitungan massa rata- rata atom sebagai berikut.
Sebuah atom klorin di alam tersedia dua macam isotop, yaitu 75% sebagai Cl-35 yang memiliki massa 35 sma dan 25% sebagai Cl-37 yang bermassa 37 sma. Tentukan massa rata-rata atom klorin tersebut!
Penyelesaian :
Massa atom rata-rata 1 atom Cl = (75% x 35)+(25x 37)/100%=35,5 sma
Jadi hasil massa atom rata-rata klorin adalah 35,5 sma.
2. Isoton
Isoton merupakan suatu atom yang memiliki jumlah neutron yang sama dengan atom lain. Contoh isoton yaitu Hidrogen dan Helium yang memiliki 2 neutron, Karbon dan Nitrogen yang memiliki 7 neutron, dan lain sebagainya.
Contoh deretan isoton adalah P1531 dan S1632. Dapat diamati jika keduanya dicari jumlah neutronnya maka akan sama jumlahnya yaitu 16.
3. Isobar
Isobar merupakan atom-atom yang memiliki nomor massa sama, tetapi nomor atomnya berbeda. Deretan isobar terdiri dari macam unsur yang berbeda. Contoh deretan isobar adalah C614 dan N714.
Kalian dapat amati dari 2 contoh isobar di atas. Keduanya memiliki nomor massa yang sama, tetapi berbeda jenis unsur dan nomor atomnya.
Bagaimana, apakah kalian sudah memahami mengenai struktur atom? Mungkin sekilas kalian akan memunculkan banyak pertanyaan-pertanyaan. Seperti misalnya:
FAQ
Kesimpulan
Jadi kesimpulannya, struktur atom adalah struktur dasar suatu materi yang tersusun atas inti atom bermuatan positif dengan dikelilingi elektron bermuatan negatif. Adapun 3 komposisi penyusunnya adalah proton, neutron, dan elektron.
Agar kalian mampu memahami lebih dalam mengenai struktur atom berdasarkan teori tokoh. Kalian dapat melihat video di bawah ini.