Laporan Praktikum Kalorimeter fisika dan kimia disertai dengan Landasan Teori serta pembahasan dan perhitungan Kalorimetri lengkap. Laporan Berikut ini merupakan laporan yang admin Laporanpraktikum.id susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
A. Tujuan Praktikum Kalorimeter
Berikut ini merupakan tujuan dalam Praktikum Kalorimeter:
- Menentukan kalor jenis suatu zat (alumunium, besi, kuningan dan tembaga)menggunakan kalorimeter
- Menghitung dan menggunakan asas black
- Memahami penggunaan kalorimeter
- Menghitung jumlah kalor yang dilepas dan diterima oleh suatu benda
B. Dasar Teori Praktikum Kalorimeter
Kalori meter merupakan suatu alat yang fungsinya untuk mengukur kalor jenis suatu zat. Salah satu bentuk kalorimeter adalah kalorimeter campuran. Kalorimeter ini terdiri dari sebuah bejana logam yang kalor jenisnya diketahui.Bejana ini biasanya ditempatkan didalam bejana lain yang agak lebih besar.Kedua bejana dipisahkan oleh bahan penyekat misalkan gabus atau wol.Kegunaan bejana luar adalah sebagai isolator agar pertukaran kalor dengan sekitar kalori meter dapat dikurangi (Keenan. 1980. Fisika untuk Universitas Jilid 1).
Kalorimeter juga dilengkapi dengan batang pengaduk. Pada waktu zat dicampurkan didalam kalori meter, air dalam kalori meter perlu diaduk agar diperoleh suhu merata sebagai akibat percampuran dua zat yang suhunya berbeda. Asas penggunaan kalori meter adalah asas black. Setiap dua benda atau lebih dengan suhu berbeda dicampurkan maka benda yang bersuhu lebih tinggi akan melepaskan kalornya, sedangkan benda yang bersuhu lebih rendah akan menyerap kalor hingga mencapai keseimbangan, yaitu suhunya sama.Pelepasan dan penyerapan kalor ini besarnya harus imbang. Kalor yang dilepaskan sama dengan kalor yang diserap sehingga berlaku hukum kekekalan energi. Pada sistem tertutup, kekekalan energi panas (kalor) ini dapat dituliskan sebagai berikut.

Pertukaran energi kalor merupakan dasar teknik yang dikenal dengan nama kalorimetri, yang merupakan pengukuran kuantitatif dari pertukaran kalor. Untuk melakukan pengukuran kalor yang diperlukan untuk menaikkan suhu suatu zat digunakan kalorimeter. Salah satu kegunaan yang penting dari kalorimeter adalah dalam penentuan kalor jenis suatu zat. Pada teknik yang dikenal sebagai “metode campuran”, satu sampel zat dipanaskan sampai temperatur tinggi yang diukur dengan akurat, dan dengan cepat ditempatkan pada air dingin kalorimeter. Kalor yang hilang pada sampel tersebut akan diterima oleh air dan kalori meter. Dengan mengukur suhu akhir campuran tersebut, maka dapat dihitung kalor jenis zat tersebut (Petrucci, Ralph H. 1987. Fisika Dasar Prinsip dan Terapan Modern Jilid 2).
Baca Juga: Laporan Praktikum Koefisien Muai Panjang
Zat yang ditentukan kalor jenisnya dipanasi sampai suhu tertentu. Dengan cepat zat itu dimasukkan kedalam kalori meter yang berisi air dengan suhu dan massanya sudah diketahui. Kalori meter diaduk sampai suhunya tidak berubah lagi. Dengan menggunakan hukum kekekalan energy, kalor jenis yang dimasukkan dapat dihitung (Syukri, S. 1999. Fisika Dasar 1).
C. Alat dan Bahan
Adapun alat dan bahan dalam Praktikum Kalorimeter ini adalah sebagai berikut:
1. Alat
- Pemanas suhu
- Termometer
- Neraca
- Kaleng susu
- Gelas Beker
- Penjepit
2. Bahan
- Kungingan
- tembaga
- Air / Aquades
- Es Batu
- Alumunium
- Besi
D. Prosedur Kerja Praktikum Kalorimeter
Berikut merupakan Prosedur kerja Praktikum Kalorimeter:
- Panaskan air dalam gelas beker pada hot plate dan masukkan semua jenis logam baik besi, alumunium, tembaga, dan kuningan didalam gelas beker tersebut.
- Timbang massa kalori meter kosong dan kalori meter yang telah diisi air pada neraca Ohauss.
- Letakkan kalorimeter yang telah diisi air dalam termos yang berisi es batu selama lima menit.
- Setelah lima menit, hitung suhu air dingin dalam kalorimeter menggunakan termometer.
- Hitung suhu air yang dipanaskan menggunakan hot plate.
- Ambil satu logam yang terdapat dalam gelas beker yang terletak diatas hotp late menggunakan penjepit.
- Masukkan logam itu kedalam kalori meter yang berisi air dingin.
- Hitung suhunya sambil diaduk hingga rata.
- Setelah selesai, ambil dan timbang massa tersebut menggunakan neraca Ohauss.
- Ulangi cara diatas pada logam selanjutnya dengan massa air yang berbeda.
E. Hasil Pengamatan
1. Bagian pertama
Hasil pengamatan bagian pertama, dengan pemanasan suhu 150 Celcius.
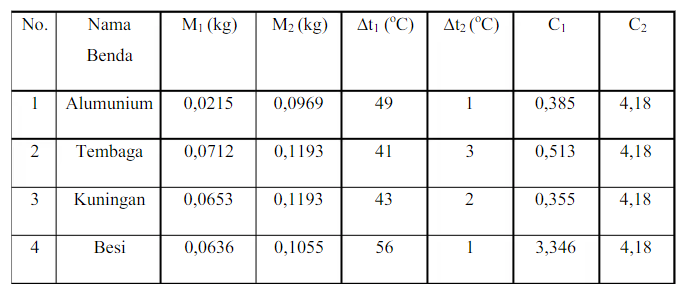
a. Alumunium

b. Tembaga

c. Kuningan

d. Besi

2. Bagian kedua
Hasil pengamatan bagian ke-dua, dengan pemanasan suhu 450 Celcius
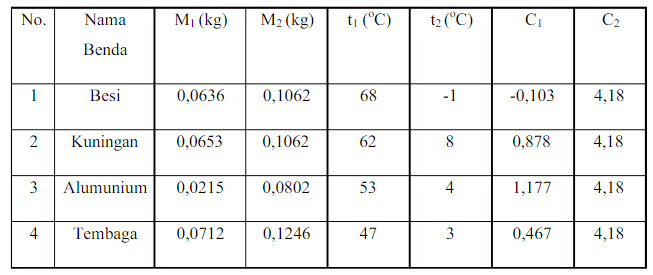
a. Besi

b. Kuningan

c. Alumunium

d. Tembaga

F. Pembahasan Praktikum Kalorimeter
berdasarkan hasil pengamatan yang telah dilakukan dapat diketahui bahwa kalori meter dapat diukur dengan melalui dengan cara memanaskan air dan benda yang kemudian dimasukkan kedalam air yang telah di dinginkan sehingga terjadi pertukaran atau pelepasan kalor dari benda ke air sehingga terjadi kesetimbangan.
Pada pengamatan percobaan yang pertama dilakukan pada suhu 150 Celscius pada benda alumunium didapatkan hasil perhitungan kalor jenis 0,385 j/kg c dan tembaga didapatkan hasil perhitungan kalor jenis 0,513 j/kg c pada percobaan kalori meter dengan benda kuningan didapatkan hasil perhitungan 0,355 j/kg c dan pada percobaan kalori meter dengan menggunakan besi didapatkan perhitungan kalor jenis 0,195 j/kg c dan pada hasil pengamatan yang kedua dengan merubah suhu menjadi 145 pada benda besi menghasilkan perhitungan kalor jenis -0,103 j/kg c dan pada benda kuningan didapatkan hasil perhitungan kalor jenis 0,878 j/kg c dan pada percobaan kalorimeter menggunakan benda alumunium didapatkan hasil perhitungan 1,77 j/kg c dan pada tembaga didapatkan hasil kalori jenis 0,467 j/kg c dari hasil pengamatan kalori jenis dapat diketahui bahwa suhu berperan penting dalam kalori meter dan jenis benda juga dapat mempengaruhi kalori meter. Perhitungan yang digunakan pada pada kalorimeter menggunakan perhitungan dari teori asas black dengan rumus:

Pada pengamatan yang telah dilakukan sesuai dengan teori . Dengan menggunakan hukum Hess, kalor reaksi suatu reaksi kimia dapat ditentukan berdasarkan data perubahan entalpi pembentukan standar, energi ikatan dan secara eksperimen. Proses dalam kalorimeter berlangsung secara adiabatik,yaitu tidak ada energi yang lepas atau masuk dari luar ke dalam kalorimeter,dan kalorimeter dengan asas black Setiap dua benda atau lebih dengan suhu berbeda dicampurkan maka benda yang bersuhu lebih tinggi akan melepaskan kalornya, sedangkan benda yang bersuhu lebih rendah akan menyerap kalor hingga mencapai keseimbangan (Petrucci,1987).
G. Kesimpulan Praktikum Kalorimeter
Dari hasil pengamatan yang telah dilakukan, Maka dalam Laporan Praktikum Kalorimeter ini dapat ditarik kesimpulan sebagai berikut:
- kalorimeter adalah ilmu dalam pengukuran panas dari reaksi kimia atau perubahan fisik.
- faktor-faktor yang mempengaruhi kalori meter adalah suhu dan jenis benda.
- kalor reaksi suatu raksi dapat ditentukan berdasarkan data perubahan entalpi pembentukan standar, energi ikatan dan secara eksperimen.
- Teori asas black berbunyi Q Lepas = Q Terima
H. Daftar Pustaka
- Keenan. 1980. Fisika untuk Universitas Jilid 1. Jakarta: Erlangga.
- Petrucci, Ralph H. 1987. Fisika Dasar Prinsip dan Terapan Modern Jilid 2 Edisi 4. Jakarta: Erlangga.
- Syukri, S. 1999. Fisika Dasar 1. Bandung: ITB.
I. Download Laporan Praktikum (PDF)
Anda dapat Mendownload Laporan Praktikum Kalorimeter dan Landasan Teori diatas lengkap dalam format PDF dengan mengklik tombol download di bawah ini.

