Laporan Praktikum Gas dan Kinetika Gas berikut ini merupakan laporan yang admin susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
Tujuan
Adapun tujuan dalam Praktikum Gas dan Kinetika Gas yakni:
- Untuk mengetahui persamaan gas ideal yang dipengaruhi oleh jumlah partikel
- Untuk mengetahui persamaan gas ideal yang dipengaruhi oleh hubungan antara gas dengan volume.
Latar Belakang
Gas merupakan komponen yang sangat penting dalam kehidupan sehari-hari. Tanpa gas, penghidupan dan sejarah manusia tidak bisa berjalan dengan lancar. Contoh sederhananya adalah sistem pernapasan manusia yang juga menggunakan gas.
Dalam ilmu fisika, gas dikaji lebih jauh dan dikenal dengan nama ilmu termodinamika, yaitu peristiwa meletusnya balon terkait dengan suhu, volume gas dan hubungan tekanan tertentu. Teori kinetik gas meninjau sifat zat secara lebih menyeluruh sebagai hasil rata-rata kelakuan partikel.
Contoh dalam kehidupan sehari-hari jika bola ditekan maka bentuknya akan berubah, namun ketika dipanaskan menggunakan air maka kembali seperti semula. Begitupun ketika balon udara dapat naik ke atas setelah apinya panas. Percobaan teori ini harus dilakukan untuk membuktikan kebenaran beberapa peristiwa diatas.
BAB II KAJIAN PUSTAKA
A. Teori Kinetik Gas
Teori kinetik gas memberikan penjelasan tentang perilaku sistem-sistem fisik yang beranggapan bahwa sebagian besar molekul mampu bergerak sangat cepat. Teori kinetik meninjau sifat secara keseluruhan.
Teori ini juga menjelaskan tentang sifat makroskopik gas seperti volume, tekanan dan suhu dengan tetap memperhatikan komposisi molekuler dan gerakannya. Teori ini membantah pandangan Isaac Newton bahwa tekanan disebabkan oleh gerakan vibrasi antara molekul.
Sebaliknya, kinetik gas menjelaskan bahwa tekanan disebabkan oleh molekul yang menumpuk dan memiliki kecepatan berbeda. Teori kinetik juga dikenal sebagai kinetik molekular atau teori tumbuhan atau teori kinetik pada gas.
Pembahasannya berada di ranah sifat gas yang saling berhubungan dengan gerakan translasi dari atom dan molekul dalam bentuk gas serta gerakannya secara bebas dan berkelanjutan. Oleh karena itu, untuk membahas sifat gas secara lebih dalam maka teori ini menggunakan pendekatan gas ideal berdasarkan 3 pengandaian, yaitu :
- Molekul gas tidak berinteraksi antara satu dengan yang lainnya. Jumlah tenaga kinetik molekul sama sebelum dan sesudah perlanggaran.
- Ukuran molekul dianggap terlalu kecil sehingga boleh diabaikan. Garis pusatnya lebih kecil dibandingkan dengan jarak putar yang dilalui antar perlanggaran.
- Gas terdiri dari beberapa molekul yang bergerak tanpa henti dan acak.
Sifat gas umum adalah mudah berubah bentuk, volume, dapat digolongkan sebagai fluida dengan kecepatan yang lebih kecil. Sedangkan sifat gas ideal adalah :
- Hukum Newton tentang gerak sudah tidak berlaku.
- Antara partikel gas dan partikel dinding tempatnya merupakan elastis sempurna.
- Jarak antara partikel gas lebih jauh dibandingkan dengan ukuran partikel.
- Partikel gas berjumlah besar, bergerak, tersebar merata dan segala arah.
Gas terdiri dari molekul yang bergerak ke segala arah dengan kecepatan tinggi dan berjalan lurus. Molekul ini selalu bertumbukan dengan molekul yang lain (dinding bejana) yang menyebabkan terjadinya tekanan.
Volume yang ditempati oleh gas lebih besar dibandingkan dengan volume molekul-molekul dari gas itu sendiri. Hal inilah yang menyebabkan gas sifatnya lebih rapat dan kecil dibandingkan dengan cairan atau zat padat biasa.
Selain itu, gas juga bersifat kompresibel atau mudah ditekan karena molekul selalu bergerak ke segala arah, mudah bercampur dengan gas yang lain dengan syarat tidak bereaksi. Contohnya adalah O2 ;CO2 dan H2; dan sebagainya.
B. Jenis-Jenis Gas
1. Gas Monoatomik
Molekul di dalamnya hanya bergerak translasi (tidak ada struktur dakhil dalam teori kinetik) sehingga U32 nRT.
2. Gas Diatomik
Setiap molekul berbentuk dumbel yang mana dua bola disambung oleh sebuah tongkat,. Molekul yang demikian mampu berotasi terhadap salah satu dari tiga sumbu paling tegak lurus, ini. Namun inersia rotasi terhadap sumbu-sumbu yang tegak lurus pada tongkat lebih layak untuk diperhatikan.
3. Gas Poliatomik
Setiap molekul mempunyai tiga atau lebih atom yang disambung secara bersama oleh tongkat dalam model sehingga mampu berotasi terhadap salah satu dari tiga sumbu paling tegak lurus. Gas poliatomik mempunyai gerak rotasi dan translasi maka,
[su_box title=”Rumus Gas Poliatomik” style=”glass” box_color=”#52ea00″ title_color=”#ffffff”]
U = 3n(12RT) + 3n(13RT) = 3Nrt,
atau Cv = dUn dT = 3R = 6 cal/mol.K,
dan Cp = 4R,
atau y = CpCp = 1,33
(Sukri, 2013)[/su_box]
Pada praktikum ini juga akan menjelaskan bahan dari sudut pandang mikroskopik yang mana molekul udara membentuk permukaan benda tegar yang menyebabkan tekanan pada atmosfer (makroskopik).
C. Persamaan Gas Ideal
[su_box title=”Beberapa Hukum Gas” style=”glass” box_color=”#52ea00″ title_color=”#ffffff”]
1. Hukum Boyle
Suhu tetap volume gas berbanding terbalik dengan tekanan yang diberikan. Secara sistematik hukumnya adalah :
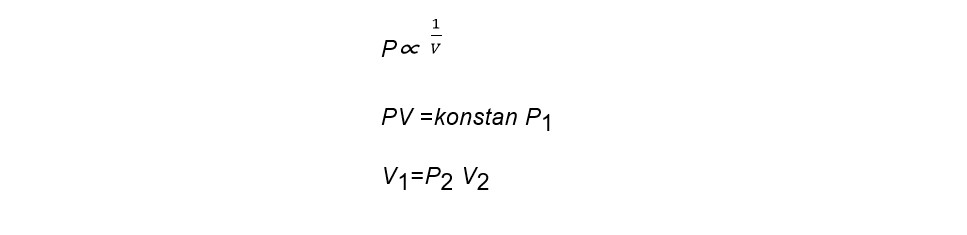
2. Hukum Charles
Hukum ini menyatakan bahwa ketika tekanan gas dipertahankan maka volume sebanding dengan suhu absolutnya:

3. Hukum Gay Lussac
Ketika gas dipanaskan dalam sebuah tabung yang volumenya tidak berubah maka tekanannya sama dengan suhu mutlaknya.
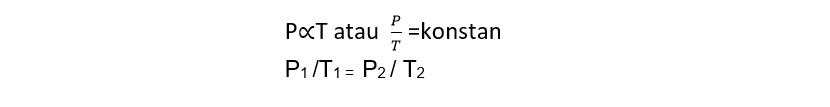
4. Hukum Boyle Gay Lussac
Dapat dituliskan sebagai berikut:
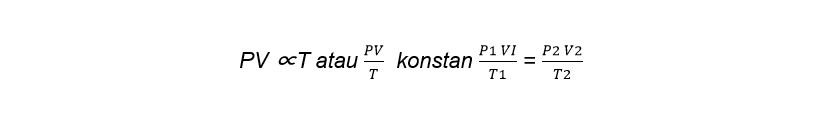
[/su_box]
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum Gas dan Kinetika Gas dilaksanakan pada:
Hari: Senin / 08 November 2020
Tempat: Laboratorium Kimia
B. Alat dan Bahan
Adapun alat dan bahan sebagai berikut:
Alat
- Model teori kinetik gas (1 set).
- Catu daya (1 buah).
- Kabel penghubung (2 buah).
Bahan
- Peluru plastik atau manik-manik (20 butir).
- Spidol (1 buah).
- Penggaris (1 buah).
C. Prosedur Kerja atau Cara Kerja
Langkah kerja pada Praktikum Gas dan Kinetika Gas sebagai berikut:
[su_box title=”Ikuti Langkah Kerja berikut” style=”glass” box_color=”#52ea00″ title_color=”#ffffff”]
- Menyusun alat kinetik gas.
- Menghubungkan model teori kinetik gas ke catu daya menggunakan kabel penghubung.
- Memasukkan 10 mani-manik ke dalam model teori kinetik gas (diumpamakan sebagai partikel yang bergerak di closed room.
- Tekan tombol on.
- Mengamati volume dan mencatat perubahan.
- Menambah manik-manik secara perlahan menjadi 15 dan 20 butir.
- Menandai perubahan ketinggian yang dicapai karena getaran menggunakan spidol dan penggaris.
- Mengulangi cara sebanyak 3 kali dan mencatat hasil pengamatan pada tabel.[/su_box]
BAB IV HASIL DAN PEMBAHASAN
A. Hasil Percobaan
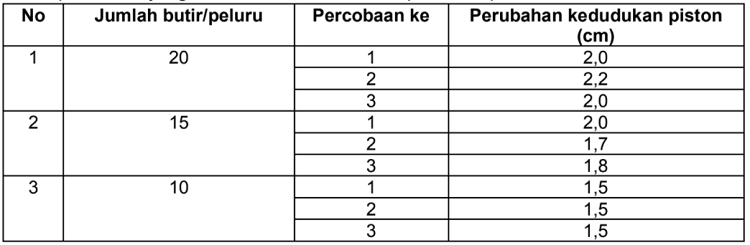
Hasil percobaan yang sudah dilakukan di atas dapat dilihat pada tabel berikut ini:
B. Pembahasan
Pada percobaan teori kinetik ini alat yang digunakan adalah model teori kinetik gas dan perlengkapan lain yang sudah dijelaskan di atas. Pada langkah percobaan ini pertama-tama merangkai terlebih dahulu alat yang digunakan dan dilanjutkan dengan memasukkan manik.
Setelah itu, peneliti memasukkan 10 butir terlebih dahulu dan mengamati ketinggian rata-rata yang sudah dicapai dan mengukurnya menggunakan penggaris. Percobaan ini dilakukan dengan tiga kali pengulangan, berlaku juga untuk manik-manik berjumlah 15 dan 20.
Peneliti mengambil perubahan rata-rata kedudukan piston atau tabung dan hasilnya sudah dipaparkan pada tabel pengamatan di atas. Tinggi manik-manik dalam piston yang digetarkan adalah 2 cm.
Cara menghitungnya adalah tinggi peluru sebelum digetarkan dikurangi tinggi peluru setelah digetarkan. Percobaan ini diulang sebanyak 3 kali dengan tujuan agar memperoleh rata-rata kedudukan.
Pada tabel hasil pengamatan inilah saat jumlah peluru 10 butir pada percobaan pertama diperoleh perubahan kedudukan 1,5 cm dan hasilnya sama saat percobaan kedua atau ketiga.
Sedangkan saat manik-manik yang dimasukkan berjumlah 15 butir diperoleh perubahan kedudukan 2,0 cm di percobaan pertama. Percobaan kedua 1, 7 cm dan ketiga 1,8 cm.
Ketika peluru atau manik-manik dimasukkan sebanyak 20 butir maka dapat diperoleh percobaan pertama 2,0 cm, kedua 2,2 cm dan ketiga 2,0 cm.
Pada hasil pengamatan di atas dapat ditarik kesimpulan bahwasanya semakin banyak jumlah peluru atau manik-manik dalam tabung maka semakin besar nilai perubahan kedudukan. Hasilnya dapat diperoleh manik-maniksebagai (n) dan kedudukan ditulis sebagai (v).
Dari tabel di atas (n) berbanding lurus dengan (v) yang artinya semakin besar tekanan maka semakin besar pula jumlah partikelnya. Sedangkan pada teori kinetik gas ini dipengaruhi oleh besaran energi dan momentum karena memiliki kecepatan v pada tabung atau piston.
Rumus tekanan gas dapat dituliskan seperti di bawah ini:
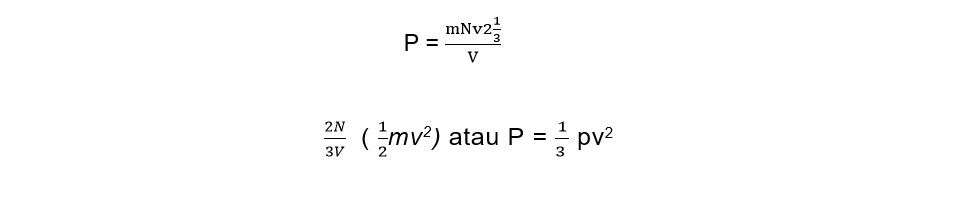
Persamaan di atas dapat juga dituliskan :
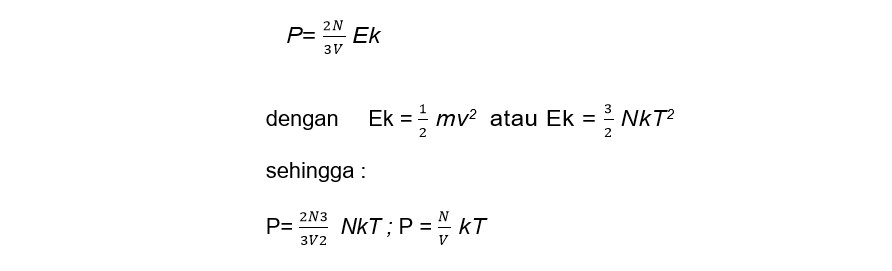
Dapat diperoleh grafik volume terhadap jumlah manik-manik yaitu:
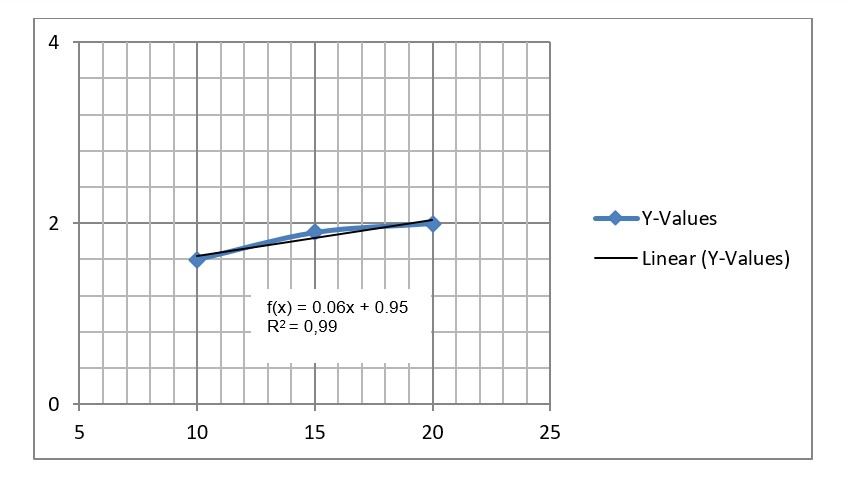
Pada grafik yang diperoleh di atas, jumlah partikel gas berbanding lurus terhadap volume. Hal ini sesuai dengan teori yang sudah dijelaskan di atas menggunakan persamaan PV =nRT yang menyatakan bahwa hubungan partikel gas dengan volume secara matematis dituliskan:
n V
Sedangkan untuk persamaan grafik adalah y = 0,057x + 0,945. Gradien grafik (m) diketahui adalah 0,057. Gradien ini menyatakan kemiringan garis terhadap garis horizontal. Sedangkan kesalahan relatif pada setiap percobaan adalah:
- Percobaan pertama 0%
- Percobaan kedua 6,3%
- Percobaan ketiga 6,8%
Semakin banyak peluru, maka semakin banyak pula kesalahan relatif. Namun percobaan ini bisa dikatakan berhasil.
BAB V PENUTUP
Kesimpulan
Kesimpulan dari uji coba ini adalah:
- Hubungan antara jumlah partikel gas dengan volume dituliskan n V.
- Besaran yang mempengaruhi teori kinetik gas adalah energi kinetik dan momentum.
- Semakin banyak jumlah partikel maka semakin besar pula volume (berbanding lurus).
Download Laporan Praktikum (PDF)
Anda Dapat Mendownload laporan Praktikum Gas dan Kinetika Gas ini dalam format PDF dengan mengklik tombol download dibawah ini.
[su_spoiler title=”Download / Unduh” style=”fancy” icon=”chevron-circle”]
Download File
PDF (126 KB)[/su_spoiler]
