Apakah kalian pernah mendengar tentang larutan elektrolit dan larutan non elektrolit? Kedua macam larutan ini banyak kita jumpai di kehidupan sehari-hari. Namun, sebelumnya kita pahami terlebih dahulu tentang apa itu larutan, yaitu campuran antara zat pelarut dan zat terlarut yang homogen.
Dalam sebuah larutan, umumnya jumlah zat pelarut lebih banyak daripada zat terlarut. Zat pelarut yang paling umum digunakan untuk membuat sebuah larutan adalah air. Sementara yang menjadi zat terlarutnya bisa berupa zat cair, zat padat atau berupa gas.
Tahukah kalian bahwa larutan memiliki kemampuan untuk menjadi penghantar listrik? Michael Faraday adalah orang pertama yang menemukan hal ini. Mari kita pahami lebih lanjut mengenai larutan berdasarkan daya hantarnya terhadap arus listrik, ciri-ciri, contoh dan berbagai informasi penting lainnya setelah pertanyaan umum berikut.
Percobaan Faraday
Percobaan yang dilakukan oleh Faraday, seorang ilmuwan dari Inggris, menyebutkan bahwa apabila arus listrik dialirkan dalam sebuah larutan elektrolit, maka akan terjadi proses elektrolisis. Proses ini akan menghasilkan gelembung gas di dalam larutan tersebut.
Gelembung gas dalam larutan terjadi karena ion positifnya mengalami reaksi reduksi, sedangkan ion negatifnya mengalami proses oksidasi. Reaksi reduksi sendiri adalah reaksi yang menyebabkan terjadinya penambahan elektron oleh sebuah ion, atom atau molekul.
Sebaliknya, proses oksidasi menjelaskan tentang pelepasan elektron oleh sebuah ion, atom atau molekul.
Berikut contoh reaksi elektrolisis berikut proses oksidasi dan reduksinya) pada larutan HCl:
HCl (aq) ====> H+ (aq) + Cl– (aq)
Reaksi reduksi yang terjadi : 2H+(aq) + 2e- =====> H2 (g)
Proses Oksidasi : 2Cl– (aq) ——> Cl2 (g) + 2e-
Pengertian dari Larutan Elektrolit dan Larutan Non Elektrolit
Apakah yang dimaksud dengan larutan elektrolit? Lalu, apa itu larutan non elektrolit? Secara umum larutan elektrolit dapat kita artikan sebagai senyawa yang apabila dilarutkan di dalam air memiliki kemampuan untuk menghantarkan arus listrik.
Sebaliknya, jika senyawa tersebut tidak memiliki kemampuan untuk menghantarkan arus listrik maka disebut sebagai larutan non elektrolit.
Cara Menentukan larutan Elektrolit dan Larutan Non Elektrolit
Salah satu cara yang dapat kalian lakukan untuk membuktikan bahwa sebuah larutan termasuk dalam larutan elektrolit atau larutan non elektrolit adalah dengan melakukan eksperimen berikut:

Bahan yang dibutuhkan:
- Gelas
- Sumber listrik (bisa menggunakan baterai atau listrik di rumah)
- Bohlam lampu
- Elektroda 2 buah
Cara Merangkai:
- Hubungkan lampu dengan kedua elektroda yang sudah kalian siapkan dan ke sumber listrik seperti gambar rangkaian di atas. Isi gelas dengan beberapa jenis larutan agar kalian mengetahui mana yang termasuk dalam larutan elektrolit kuat, larutan elektrolit lemah atau larutan non elektrolit.
- Setelah semua terpasang, lakukan pengujian dengan mencelupkan kedua elektroda ke dalam larutan yang kamu pilih. Pastikan bahwa kalian memberi jarak diantara dua elektroda yang ada seperti pada gambar. Sambungkan dengan sumber energi dan celupkan elektroda pada masing-masing cairan, amati hasilnya.

Hasil Pengujian Terhadap Beberapa Larutan
| Nama Larutan | Nyala Lampu | Gelembung Gas | Jenis Larutan |
| Larutan Cuka | Tidak Ada | Ada | Elektrolit Lemah |
| Larutan Ammonia | Tidak Ada | Ada | Elektrolit Lemah |
| Air Aki | Ada | Ada | Elektrolit Kuat |
| Air Kapur | Ada | Ada | Elektrolit Kuat |
| Larutan Urea | Tidak Ada | Tidak Ada | Non Elektrolit |
| Larutan Alkohol | Tidak Ada | Tidak Ada | Non Elektrolit |
| Larutan Gula (Glukosa) | Tidak Ada | Tidak Ada | Non Elektrolit |
Mengapa Larutan Dapat Menghantarkan Listrik?

Svante August Arrhenius, seorang ahli kimia yang berasal dari negara Swedia menjelaskan alasan mengapa larutan elektrolit dapat menghantarkan listrik dengan baik, sedangkan larutan non elektrolit tidak.
Dalam teorinya tentang ionisasi, Arrhenius menyebutkan bahwa larutan elektrolit dapat menjadi penghantar listrik karena didalamnya mengandung atom atau kumpulan atom bermuatan listrik yang bergerak bebas.
Atom atau kumpulan atom bermuatan listrik tersebut kemudian disebut dengan nama ion. Ion-ion inilah yang memiliki peran penting dalam menghantarkan arus listrik dengan media larutan. Proses berubahnya suatu senyawa menjadi ion-ion dalam sebuah larutan dikenal dengan nama proses ionisasi.
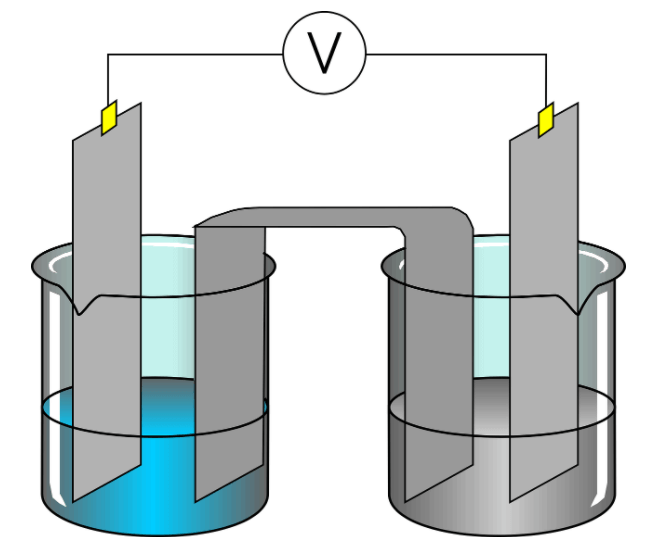
Pada gambar di atas, kalian dapat melihat bahwa larutan kupri klorida (CuCl2) yang merupakan larutan elektrolit kuat dapat terurai secara sempurna. Berikut proses penguraiannya:
CuCl2 —–> Cu2+ + Cl–
Jadi larutan CuCl2 terionisasi menjadi ion Cu2+ dan ion CL–. Kalian akan melihat sendiri dalam percobaan di atas bahwa ion-ion yang memiliki muatan positif akan bergerak menuju elektroda yang dihubungkan dengan kutub negatif (katoda). Sedangkan ion bermuatan negatif akan bergerak menuju elektroda yang dihubungkan dengan kutub positif (anoda).
Pada larutan elektrolit lemah, tidak dapat menghantarkan listrik dengan baik karena hanya terdapat sedikit ion dalam larutan tersebut. Ion yang dapat bergerak bebas pada larutan ini sangat sedikit sehingga tidak memiliki kemampuan yang baik dalam menghantarkan arus listrik.
Mengenal Larutan Elektrolit
Seperti telah disinggung di atas, larutan elektrolit adalah larutan yang memiliki kemampuan untuk menghantarkan arus listrik. Larutan ini dapat diklasifikasikan menjadi beberapa jenis tergantung dari cara kita mengelompokkannya.
Pada larutan non elektrolit dalam hal ini kita gunakan etanol, kalian melihat bahwa larutan tersebut sama sekali tidak memiliki ion karena tidak mengalami proses ionisasi. Larutan tetap berbentuk molekul sehingga secara otomatis memiliki sifat isolator atau tidak dapat menghantarkan listrik.
Berdasarkan kemampuannya dalam menghantarkan daya listrik, larutan elektrolit diklasifikasikan menjadi 3, yaitu:
1. Larutan Elektrolit Kuat
Merupakan jenis larutan dengan daya hantar listrik sangat baik. Hal ini terjadi karena larutan ini memiliki banyak ion bebas di dalamnya sebagai akibat dari ionisasi yang sempurna dimana semua zat elektrolitnya berubah menjadi ion. Salah satu contoh ionisasi sempurna adalah NaCl yang terurai secara sempurna menjadi ion Na+ dan Cl.
Berikut beberapa ciri dari larutan elektrolit kuat yang perlu kalian perhatikan:
- Merupakan penghantar listrik yang baik dan kuat
- Larutan terionisasi secara sempurna
- Memiliki derajat atau tetapan ionisasi (a) a=1
- Mampu menyalakan lampu dengan terang serta menghasilkan banyak gelembung gas jika dilakukan pengujian.
- Larutan terdiri dari larutan
2. Ciri-ciri Larutan Elektrolit Kuat
- Asam kuat : HI, HCl, H2SO4, HCIO4
- Basa kuat : KOH, NaOH, Ca(OH)2, Mg(OH)2
- Garam : BaCl2, NaCl, (secara umum garam adalah larutan elektrolit kuat).
3. Larutan Elektrolit Lemah
Merupakan larutan yang tidak mengalami ionisasi secara sempurna yang menyebabkan larutan ini hanya memiliki sedikit ion yang dapat menjadi penghantar listrik yang baik.
4. Ciri-ciri Larutan Elektrolit Lemah
Berikut beberapa ciri-ciri dari larutan elektrolit lemah untuk kalian pahami dan mengerti:
- Merupakan penghantar listrik yang lemah atau kurang baik
- Larutan tidak terionisasi secara sempurna (hanya terionisasi sebagian)
- Derajat ionisasi (a) adalah 0 < a < 1
- Menghasilkan gelembung gas dalam jumlah kecil dan nyala lampu yang redup jika dilakukan pengujian
- Larutan terdiri dari:
- Asam Lemah : H3PO4, CH3COOH
- Basa Lemah : Fe (OH)2, Al (OH)2, AgOH
5. Larutan Non Elektrolit
Merupakan larutan yang tidak memiliki kemampuan sebagai penghantar arus listrik. Larutan ini juga dikenal dengan sebutan Isolator.
6. Ciri-ciri Larutan Non ELektrolit:
Kenali dan pahami ciri dari larutan non elektrolit di bawah ini:
- Merupakan penghantar listrik yang buruk atau dikenal dengan istilah isolator
- Larutan tidak dapat terionisasi
- Derajat ionisasi nya (a) a = 0
- Tidak dapat membuat lampu menyala dan tidak menimbulkan gelembung gas jika dilakukan pengujian.
- Contoh larutan non elektrolit adalah semua larutan lain selain larutan basa, larutan asam dan garam. Contoh larutan ini antara lain: glukosa (C6H12O6), gula tebu (C12H22O11), larutan urea (CO3NH2)2) dan etanol (C2H5OH)
Elektrolit Asam, Basa Serta Garam
Larutan elektrolit dapat berwujud asam, basa dan garam. Sebagian asam dan basa masuk ke dalam kategori elektrolit kuat dan sisanya dikategorikan sebagai elektrolit lemah. Sedangkan garan, karena mudah larut dalam air semuanya termasuk dalam kategori elektrolit kuat.
Contoh senyawa yang termasuk dalam kategori elektrolit kuat:
- Asam organik, merupakan asam kuat, contohnya HCl, HCIO3, H2SO4, serta HNO3
- Basa alkali dan alkali tanah merupakan basa kuat, contohnya NaOH, KOH, Ca(OH)2 serta Ba(OH)2
- Garam contohnya NaCl, Kl serta Al2(SO4)3
Contoh senyawa yang termasuk dalam kategori elektrolit lemah:
- Asam lemah, asam anorganik serta mayoritas asam organik seperti CH3COOH, H2CO3, HCN serta H2S
- Basa lemah seperti mayoritas basa organic dan amonia, contoh Ni(OH)2 dan NH4Oh
- Garam yang susah larut dalam air, seperti CaCrO4, AgCl serta Pbl2
Mengenal Derajat Ionisasi
Apa Itu derajat ionisasi? Jika kalian melarutkan suatu zat ke dalam air, ada 3 kemungkinan yang akan terjadi, yaitu:
- Zat tersebut larut secara sempurna dalam air
- Zat tersebut larut sebagian
- Zat tersebut tidak larut sama sekali dalam air
Jumlah spesi yang dapat mengalami proses ionisasi dalam air dapat kalian hitung dengan menggunakan derajat ionisasi (a). Derajat ionisasi dapat kita artikan sebagai perbandingan dari jumlah mol zat terionisasi dengan jumlah mol zat semula, yang ditulis dengan rumus berikut

Sumber dari Ion Dalam Larutan Elektrolit
Ada dua macam sumber ion yang terdapat dalam larutan elektrolit yang membuatnya memiliki kemampuan sebagai konduktor yang baik, yaitu:
1. Senyawa Ionik
Merupakan senyawa yang terdiri dari ion-ion walaupun dalam bentuk kering atau padat. Contoh senyawa ionic adalah
- NaOH : tersusun dari ion Na+ dan ion OH-
- NaCl : tersusun dari ion Na+ dan Cl-
Ketika dalam bentuk padat, senyawa ionik tidak dapat menghantarkan arus listrik karena ion-ion yang ada di dalamnya saling terikat secara kuat. Ikatan yang kuat tersebut menghalangi ion-ion tersebut untuk dapat bergerak bebas pada waktu kalian beri beda potensial.
Tetapi coba kalian melarutkan senyawa ionik tersebut ke dalam pelarut polar seperti air. Kalian akan melihat bahwa senyawa ionic tersebut berubah menjadi suatu elektrolit.
Proses larutnya senyawa tersebut menyebabkan ion-ion yang tadinya terikat kuat menjadi terlepas dan bisa bergerak bebas dengan air sebagai mediumnya.
Satu hal yang perlu kalian ketahui adalah bahwa semua senyawa ionic yang larut dalam air berikut lelehan senyawa ionik adalah sebuah elektrolit. Hanya saja lelehan senyawa ionik memiliki kemampuan lebih dalam menghantarkan arus listrik dibandingkan dengan larutannya.
Hal ini dikarenakan susunan ion yang ada pada lelehan senyawa ionik lebih rapat sehingga ion-ion tersebut dapat bergerak lebih cepat ke arah katoda dan anoda ketika kalian beri beda potensial.
2. Senyawa Kovalen Polar
Dalam keadaan murni, senyawa kovalen polar dan senyawa kovalen nonpolar tidak dapat menghantarkan arus listrik. Senyawa kovalen polar hanya dapat menjadi konduktor yang baik jika dilarutkan dengan menggunakan zat pelarut yang tepat. Kombinasi antara senyawa kovalen polar dengan zat pelarut yang tepat akan mampu menghasilkan ion-ion.
Contoh senyawa kovalen polar yang dapat menghantarkan listrik dengan baik jika dilarutkan dalam air adalah:
- HCl(aq) ↔ H+(aq) + Cl–(aq)
- H2SO4(aq) ↔ 2 H+(aq) + SO42–(aq)
Contoh senyawa kovalen polar yang menjadi elektrolit lemah (konduktor yang kurang baik) jika dilarutkan dalam air adalah
- NH3(aq) + H2O(l ) ↔ NH4+(aq) + OH–(aq)
Manfaat larutan Elektrolit
Tahukah kalian bahwa larutan elektrolit banyak kita temui dalam kehidupan sehari-hari dan memiliki peran penting dalam kehidupan manusia? Ada banyak peran larutan elektrolit yang tidak dapat kita anggap enteng karena memiliki peran penting dalam suatu tugas tertentu.
Berikut beberapa contoh peran larutan elektrolit dalam kehidupan manusia:
- Memiliki peran penting dalam pembentukan hormon manusia
- Berperan dalam membuat impuls pada saraf lancar dan berfungsi dengan baik
- Merupakan ion yang berfungsi untuk mengaktifkan enzim pada tubuh manusia
- Digunakan sebagai sel elektrokimia pada mesin kendaraan contohnya baterai, aki atau jembatan garam
- Digunakan sebagai parameter atau indikator untuk mengukur kadar pencemaran air di suatu wilayah
Cara Mengukur Kadar Pencemaran Air Menggunakan larutan Elektrolit adalah dengan mengukur jumlah atau kadar dari hal-hal berikut:
- pH atau tingkat keasaman yang ada pada air yang akan diuji
- Biochemical Oxygen Demand (BOD) yaitu jumlah oksigen dalam air sebagai diperlukan oleh setiap makhluk yang hidup di dalamnya
- Dissolved Oxygen (DO) yaitu jumlah oksigen terlarut dalam air
- Chemical Oxygen Demand (COD) yaitu jumlah oksigen yang diperlukan oleh setiap makhluk hidup yang ada di dalam air tersebut untuk melakukan berbagai reaksi kimia
- Total Dissolved Solid (TDS) yaitu jumlah keseluruhan zat terlarut yang ada di air
Jika air yang diuji memiliki kadar pH netral yaitu ada di kisaran angka 7 dengan tingkat BOD, COD dan TDS rendah sedangkan tingkat BO nya tinggi, maka air tersebut dinyatakan baik. Namun, jika kadar pH dari air yang diuji lebih kecil dari angka 7 (Bersifat asam) atau lebih dari 7 (bersifat basa), dengan kadar DO rendah dan kadar BOD, COD dan TDS tinggi, maka air tersebut dalam keadaan buruk.
Video Pembelajaran mengenai larutan elektrolit dan larutan non elektrolit
Semoga pembahasan mengenai larutan elektrolit dan larutan non elektrolit di atas dapat kalian pahami dengan baik. Untuk pembahasan lebih jelas, kalian dapat menonton video youtube diatas ini.
Daftar Pustaka
- Jasa Penulis Artikel
- https://sites.google.com/site/trayda1afrianti/ materi/kelas-x/ikatan-kimia
- https://www.harapanrakyat.com/ 2020/06/larutan-elektrolit-dan-non-elektrolit/
- https://www.harapanrakyat.com/ 2020/06/larutan-elektrolit-dan-non-elektrolit/
- https://www.gurupendidikan.co.id/elektrolit/
- https://pahamify.com/blog/artikel/ kimia-kelas-x-ipa-larutan-elektrolit-dan-nonelektrolit/
- https://www.quipper.com/id/blog/ mapel/kimia/larutan-elektrolit-kimia-kelas-10/
- https://blog.ruangguru.com/ memahami-larutan-elektrolit-dan-non-elektrolit
- https://www.studiobelajar.com/ larutan-elektrolit-dan-non-elektrolit/
- http://alpha.chem.umb.edu/chemistry/ ch115/carter/files/103handouts/Electrolytes.pdf