Laporan Praktikum Elektrolisis, Praktikum Elektrolisis Pada Besi dan Logam, Praktikum kimia elektrolisis larutan kalium iodida. Laporan Berikut ini merupakan laporan yang admin Laporanpraktikum.id susun dari berbagai sumber dan referensi, semoga laporan ini dapat membantu pembaca semuanya.
BAB I PENDAHULUAN
A. Latar Belakang Praktikum Elektrolisis
Sel elektron kimia merupakan bagian dari ilmu kimia yang mempelajari perubahan zat dan arus listrik. Perubahan zat-zat yang berupa reaksi kimia tersebut berlangsung dalam sel elektrokimia, yang merupakan reaksi redoks. Dan reaksi redoks terjadi pada sel elektrolisis dan sel volta.
Sel elektrolisis merupakan pemanfaatan arus listrik untuk menghasilkan reaksi redoks. Oleh karena itu, elektrolisis adalah proses penguraian suatu senyawa dengan pengaliran arus listrik yang melaluinya. Dalam elektrolisis, terjadi perubahan energi listrik menjadi energi kimia. Dalam sel volta reaksi redoks berlangsung secara spontan, dan energi kimia yang menyertai reaksi kimia diubah menjadi energi listrik. Sedangakan elektrolisis adalah reaksi kebalikannya yang potensial selnya negatif atau dapat dikatakan dalam keadaan normal tidak akan terjadi reaksi dan reaksi akan terjadi bila diinduksi dengan energi listrik dari luar.
Banyak zat yang dibuat dengan cara elektrolisis. Hal tersebut disebabkan banyak zat tidak dijumpai secara bebas di alam, tetapi berada dalam senyawanya. Contoh zat yag diproduksi dengan cara elektrolisis adalah logam alkali, aluminium, unsur halogen, NaOH, dan H2O2. Selain itu elektrolisis juga dapat digunakan untuk penyepuhan (electroplating) yang merupakan usaha untuk melindungi logam dari perkaratan dan menambah daya tarik. Akibatnya, logam yang telah disepuh lebih awet dan berharga lebih mahal karena kelihatan lebih menarik.
B. Pembatasan Masalah
Pembatasan masalah dalam Laporan Praktikum Elektrolisis ini adalah :
Agar pembatasan masalah dalam praktikum ini memiliki ruang lingkup yang jelas maka pembatasan masalahnya adalah “Larutan KI mengalami reaksi reduksi oksidasi selama elektrolisis berlangsung”.
C. Rumusan Masalah
Rumusan masalah dalam Laporan Praktikum Elektrolisis ini adalah :
- Bagaimana proses elektrolisis larutan KI?
- Zat apakah yang terjadi sebagai hasil elektrolisis pada anoda?
- Ion apakah yang terbentuk pada katoda sebagai hasil elektrolisis?
D. Tujuan Praktikum
Tujuan Laporan Praktikum Elektrolisis ini adalah :
- Mengetahui proses elektrolisis larutan KI
- Mengetahui zat apakah yang terjadi sebagai hasil elektrolisis pada anoda
- Mengetahui ion apakah yang terbentuk pada katoda sebagai hasil elektrolisis
BAB II KAJIAN PUSTAKA
Elektrokimia adalah bagian dari ilmu kimia yang mempelajari hubungan antara reaksi kimia dan aliran listrik. Aliran listrik merupakan aliran sesuatu yang bermuatan seperti elektron. Reaksi kimia manakah yang berhubungan dengan adanya aliran elektron? Reaksi yang berhubungan dengan aliran elektron adalah reaksi yang melibatkan pelepasan dan penerimaan elektron atau yang kita kenal dengan reaksi oksidasi dan reduksi atau reaksi redoks (Mulyani dan Hendrawan, 2014).
Elektrolisis adalah peristiwa penguraian elektrolit dalam sel elektrolisis oleh arus listrik. Dalam sel volta/galvani, reaksi oksidasi reduksi berlangsung secara spontan, dan energi kimia yang menyertai, dan energi kimia yang menyertai reaksi kimia diubah menjadi energi listrik. Sedangkan elektrolisis merupakan reaksi kebalikan dari sel volta/galvani yang potensial selnya negatif atau dengan kata lain, dalam keadaan normal tidak terjadi reaksi dan dapat terjadi bila diinduksi dengan energi listrik dari luar (Pratiwi, 2014).
Sel elektrolisis tersusun atas elektroda positif (anoda dan elektroda negatif (katoda). Pada anoda terdai oksidasi sedangkan pada katoda terjadi reaksi reduksi. Ada dua tipe elektroda, yakni elektroda inert dan reaktif. Bila anoda berupa elektroda inert, reaksi oksidasi sangat bergantung pada jenis anion yang ada dalam larutan, sebaliknya bila anoda berupa elektroda reaktif maka elektroda itu akan larut. Karbon merupakan salah satuelektroda inert yang paling murah dibandingkan dengan elektroda inert yang lain.Pemakaian karbon aktif sebagai elektroda telah banyak dikembangkan, baik hanya sebatas sebagai research maupun skala industri. Karbon memiliki sifat-sifat antara lain, tahan terhadap medium asam maupun basa, ukuran pori dan luas muka spesifik dapat dikontrol, bersifat inert, mudah ditempeli dengan logam, memiliki luas muka spesifik yang relatif tinggi, dan mudah diperoleh dengan harga yang relatif murah. Oleh karena itu dalam penelitian ini akan digunakan karbon sebagai elektroda (Daryoko, 2009).
Ada dua jenis elektroda: (a) Anoda: pada sel elektrolisis, sumber eksternal tegangan didapat dari luar, sehingga anoda bermuatan positif apabila dihubungkan dengan katoda. Dengan demikian ion-ion bermuatan negatif mengalir ke anoda untuk dioksidasi. (b).Katoda: pada sel elektrolisis, katoda adalah elektroda yang bermuatan negatif. Ion-ion bermuatan positf (kation mengalir ke elektroda ini untuk direduksi. Dengan demikian, pada sel elektrolisis elektron didapat dari aki/ baterai eksternal, masuk melakui katoda dan keluar lewat anoda.
Elektroda-elektroda gas disini elektroda inert (Pt, C, Au) yang berhubungan dengan gas pada tekanan 1 atm (kecuali ditentukan) dan ion-ionnya dalam larutan, misalnya elektroda gas hidrogen dan lain-lain. Sifat elektroda inert akan sedemikian rupa sehingga bila tegangan eksternal diubah sedikit saja dari nilai kesetimbangan, reaksi akan terjadi satu arah atau sebaliknya. Elektroda logam-ion logam dicelupkan dalam suatu larutan yang mengandung ion-ion logam tersebut, dan elektroda logam ikut berperan pada reaksi kimia. Reaktivitas logam akan menjadi perantara, kalau tidak, logam-logam reaktif akan bereaksi dengan air dan tidak bekerja sebagai elektroda. Sebagai contoh ialah elektroda tembaga yang dicelupkan dalam larutan sulfat tembaga.(Dogra, 2009).
Hipotesis
Terdapat perubahan warna yang terjadi pada elektrolisis larutan KI, yang menandakan zat-zat terelektrolisis masing-masing anoda-katoda.
BAB III METODE PRAKTIKUM
A. Waktu dan Tempat
Praktikum elektrolisis ini kami lakukan pada :
Hari :
Tempat :
B. Alat dan Bahan
Adapun alat dan bahan dalam Praktikum Elektrolisis adalah sebagai berikut:
Alat
- Pipa U
- adaptor/ sumber listrik
- elektroda karbon
- kabel
- gelas kimia
- pipet tetes
- statif
Bahan
- larutan KI
- indikator pp
- air suling
C. Prosedur Kerja atau Cara Kerja
- Pasang pipa U pada statif
- Masukkan larutan KI pada pipa U hingga tersisa 2 cm dari permukaan pipa U
- Celupkan elektroda karbon pada masing-masing lubang pipa U
- Pasang penjepit buaya pada elektroda karbon
- Pasang ujung penjepit buaya lainnya pada sumber arus
- Sambung arus selama 5 menit atau hingga terbentuk warna coklat
- Pastikan arus warna coklat saat sudah mencapai 1/4 tinggi pipa U
- Tambahkan 3 tetes indokator pp pada katoda (-), amati warna yang terjadi
- Tambahkan 3 tetes indokator pp pada anoda (+), amati warna yang terjadi
BAB IV HASIL DAN PEMBAHASAN
Adapun pembahasan dalam Laporan Praktikum Elektrolisis ini adalah sebagai berikut:
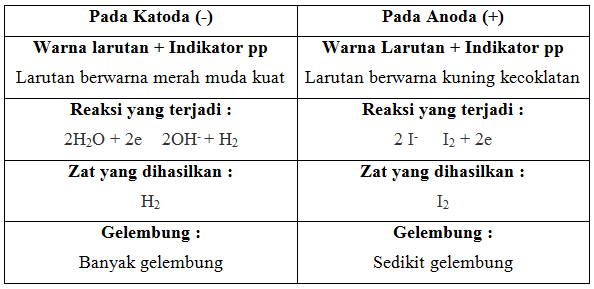
Pada praktikum kali ini, melakukan percobaan mengenai elektrolisis pada larutan kalium iodida (KI). Ketika reaksi berlangsung, pada Katoda tidak mengalami perubahan warna. Namun, setelah ditambakan fenolftalein terjadi perubahan warna menjadi merah muda pekat. Hal tersebut menandakan bahwa pada Katoda elektrolisis bersifat basa serta terdapat ion K+ sehingga mereduksi air direduksi menghasilkan H2 dan OH–. Hal tersebut dapat ditandai dengan munculnya gelembung, maka reaksi yang terjadi yaitu :
2H2O + 2e → H2 + 2OH–
Sedangkan pada anoda mengalami perubahan warna dari bening menjadi kuning kecoklatan.Warna kuning pada Anoda menandakan bahwa di Anoda mengandung gas iodine. Warna kuning kecoklatan ini muncul setelah ditambahkan indikator pp. Pada anoda terdapat ion I– yang kemudian dioksidasi menjadi unsurnya yaitu I2, maka reaksi yang terjadi di anoda adalah :
2I– → I2 + 2e
BAB V PENUTUP
Kesimpulan
Berdasarkan dari percobaan yang telah dilakukan, maka dapat disimpulkan bahwa :
Larutan KI mengalami reaksi reduksi oksidasi selama elektrolisis berlangsung. Pada anoda terjadi reaksi oksidasi. Pada elektrolisis larutan KI menghasilkan io I-, karena ion I- lebih mudah teroksidasi dari pada air. Pada katoda terjadi reaksi reduksi H2O menjadi ion OH- dan gas H2.
Daftar Pustaka
Adapun Daftar Rujukan Berbagai sumber diatas, adalah sebagai berikut:
- Daryoko, M., Sutoto, Heriyanto, K., dan Suwardiyono. 2009. Optimasi Proses Reaksi Pembangkitan Ag2+ pada Sel Elektrolisis Berkapasitas Satu Liter, Seminar Nasional V SDM Teknologi Nuklir Yogyakarta, 5 November
- DOGRA SK,DOGRA S. 2009. Kimia Fisik dan Soal-Soal. Jakarta: UI-Press
- Mulyani, S. dan Hendrawan. (2003). Common Texbook (Edisi Revisi) Kimia Fisika II. Bandung: Jurusan Pendidikan Kimia FPMIPA UPI.
- Pratiwi Purnama, Sari. 2014. PROTOTYPE HIDROGEN FUEL GENERATOR (Pengaruh Suplay Arus Listrik dengan Elektrolit Natrium Hidroksida Terhadap Produksi Gas Hidrogen). Palembang. Politeknik Negeri Sriwijaya.
Download Laporan Praktikum (PDF)
Kalian dapat mendowload laporan Praktikum Elektrolisis ini dengan format PDF dengan mengklik tombol download dibawah ini.

